题目内容
浙江海洋经济发展示范区建设已上升为国家战略,海洋经济将成为浙江经济转型升级发展的重点.请回答下列问题:

(1)被称作海洋元素的是 .
A.Na B.Cl C.Mg D.Br E.I
(2)工业上常以食盐和水为原料制备氯气,请写出化学方程式 .
(3)从海水中提取食盐和溴的过程如图1.
①步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br?,其目的为富集溴元素,请写出步骤Ⅰ的离子方程式: ,
步骤Ⅱ的化学方程式: .
②在3mL溴水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象为图2中 .

(1)被称作海洋元素的是
A.Na B.Cl C.Mg D.Br E.I
(2)工业上常以食盐和水为原料制备氯气,请写出化学方程式
(3)从海水中提取食盐和溴的过程如图1.
①步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br?,其目的为富集溴元素,请写出步骤Ⅰ的离子方程式:
步骤Ⅱ的化学方程式:
②在3mL溴水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象为图2中
考点:海水资源及其综合利用,物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)溴元素又称“海洋元素”;
(2)饱和食盐水在直流电的条件下生成氢氧化钠、氯气和氢气;
(3)①氯气能氧化溴离子得到氯离子和单质溴;二氧化硫吸收溴单质,Br元素的化合价由0降低为-1价,Br2在反应中作氧化剂,表现氧化性,S元素的化合价由+4价升高到+6价,SO2作还原剂;
②四氯化碳和水不互溶,且溴在四氯化碳中的溶解度大于水中的溶解度,溴溶于四氯化碳后溶液呈橙红色,据此分析解答.
(2)饱和食盐水在直流电的条件下生成氢氧化钠、氯气和氢气;
(3)①氯气能氧化溴离子得到氯离子和单质溴;二氧化硫吸收溴单质,Br元素的化合价由0降低为-1价,Br2在反应中作氧化剂,表现氧化性,S元素的化合价由+4价升高到+6价,SO2作还原剂;
②四氯化碳和水不互溶,且溴在四氯化碳中的溶解度大于水中的溶解度,溴溶于四氯化碳后溶液呈橙红色,据此分析解答.
解答:
解:(1)地球上99%的溴元素存在于海水中,所以溴元素有“海洋元素”之称,故答案为:D;
(2)饱和食盐水在直流电的条件下生成氢氧化钠、氯气和氢气:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
(3)①氯气能氧化溴离子得到氯离子和单质溴:2Br-+Cl2═Br2+2Cl-,二氧化硫吸收溴单质,Br元素的化合价由0降低为-1价,Br2在反应中作氧化剂,表现氧化性,S元素的化合价由+4价升高到+6价,SO2作还原剂,发生反应:Br2+SO2+2H2O=H2SO4+2HBr,
故答案为:2Br-+Cl2═Br2+2Cl-;Br2+SO2+2H2O=H2SO4+2HBr;
②根据四氯化碳能萃取溴水中的溴,但密度大于水的密度,看到的现象是溶液分层,溴溶解四氯化碳中呈橙红色,所以下层呈橙红色,上层是水层,呈无色,
故答案为:D.
(2)饱和食盐水在直流电的条件下生成氢氧化钠、氯气和氢气:2NaCl+2H2O
| ||
| ||
(3)①氯气能氧化溴离子得到氯离子和单质溴:2Br-+Cl2═Br2+2Cl-,二氧化硫吸收溴单质,Br元素的化合价由0降低为-1价,Br2在反应中作氧化剂,表现氧化性,S元素的化合价由+4价升高到+6价,SO2作还原剂,发生反应:Br2+SO2+2H2O=H2SO4+2HBr,
故答案为:2Br-+Cl2═Br2+2Cl-;Br2+SO2+2H2O=H2SO4+2HBr;
②根据四氯化碳能萃取溴水中的溴,但密度大于水的密度,看到的现象是溶液分层,溴溶解四氯化碳中呈橙红色,所以下层呈橙红色,上层是水层,呈无色,
故答案为:D.
点评:本题考查了海水资源的综合利用,涉及到海洋元素、海水提溴工艺、萃取等知识点,注意物质的分离、提纯应把握物质的性质的异同,掌握从海水中提取食盐和溴的原理为解答该题的关键,题目难度中等.

练习册系列答案
相关题目
下列各溶液中能大量共存的离子组是( )
| A、碳酸氢钠溶液中:K+、SO42-、Cl-、H+ |
| B、使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl- |
| C、使酚酞试液呈红色的溶液中:Mg2+、Cu2+、SO42-、K+ |
| D、c(H+)=10-14mol/L的溶液中:Na+、AlO2-、S2-、SO32- |
 如图所示装置Ⅰ是一种可充电电池,装置Ⅱ为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3
如图所示装置Ⅰ是一种可充电电池,装置Ⅱ为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3| 放电 |
| 充电 |
| A、装置(Ⅰ)中Na+从右到左通过离子交换膜 |
| B、A电极的电极反应式为:NaBr3+2Na++2e-═3NaBr |
| C、b电极的电极反应式为:2Cl--2e-=Cl2↑ |
| D、每有0.1mol Na+通过离子交换膜,b电极上就生成标准状况下气体1.12L |
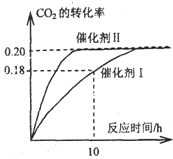 I.已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-87.4kJ?mol-1.300℃时,在一定容积的密闭容器中,当c(CO2)=1.00kJ?mol-1、c(H2)=1.60kJ?mol-1开始反应,结果如图所示,回答下列问题:
I.已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-87.4kJ?mol-1.300℃时,在一定容积的密闭容器中,当c(CO2)=1.00kJ?mol-1、c(H2)=1.60kJ?mol-1开始反应,结果如图所示,回答下列问题:


 铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:
铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题: