题目内容
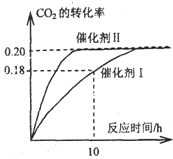 I.已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-87.4kJ?mol-1.300℃时,在一定容积的密闭容器中,当c(CO2)=1.00kJ?mol-1、c(H2)=1.60kJ?mol-1开始反应,结果如图所示,回答下列问题:
I.已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-87.4kJ?mol-1.300℃时,在一定容积的密闭容器中,当c(CO2)=1.00kJ?mol-1、c(H2)=1.60kJ?mol-1开始反应,结果如图所示,回答下列问题:(1)使用催化剂I时,反应在10小时内的平均反应速率:
V(H2)=
(2)下列叙述正确的是
A.当容器内气体的密度不再改变时,反应不一定达到平衡状态
B.充入氩气增大压强有利于提高CO2的转化率
C.CO2平衡转化率:在上述反应条件下,催化剂Ⅱ比催化剂Ⅰ高
D.催化效率:在上述反应条件下,催化剂Ⅱ比催化剂Ⅰ高
(3)根据图中数据,计算此反应在300℃时的平衡常数.(写出计算过程)
(4)将上述平衡体系升温至400℃,平衡常数:K(400℃)
考点:转化率随温度、压强的变化曲线
专题:化学平衡专题
分析:(1)根据反应在10小时内二氧化碳的转化率计算出消耗二氧化碳的物质的量浓度,再计算出用二氧化碳表示的平均反应速率,最后根据反应速率与化学计量数的关系计算出用氢气表示的反应速率;
(2)A、该反应两边都是气体,容器容积不变,所以密度始终不变;
B、充入稀有气体,不影响反应体系中各组分浓度,化学平衡不移动;
C、催化剂只影响反应速率,不影响化学平衡;
D、根据图示可知,在催化剂Ⅱ作用下的反应速率大于比催化剂Ⅰ作用下的反应速率;
(3)根据图象中达到平衡状态时二氧化碳的转化率、利用化学平衡三段式求算出达到平衡状态时各组分的浓度,然后利用平衡常数表达式计算出该温度下的平衡常数;
(4)该反应为放热反应,温度升高,化学平衡向着逆向移动,化学平衡常数减小;
(2)A、该反应两边都是气体,容器容积不变,所以密度始终不变;
B、充入稀有气体,不影响反应体系中各组分浓度,化学平衡不移动;
C、催化剂只影响反应速率,不影响化学平衡;
D、根据图示可知,在催化剂Ⅱ作用下的反应速率大于比催化剂Ⅰ作用下的反应速率;
(3)根据图象中达到平衡状态时二氧化碳的转化率、利用化学平衡三段式求算出达到平衡状态时各组分的浓度,然后利用平衡常数表达式计算出该温度下的平衡常数;
(4)该反应为放热反应,温度升高,化学平衡向着逆向移动,化学平衡常数减小;
解答:
解:(1)用催化剂I时,反应在10小时内二氧化碳的转化率为0.18,二氧化碳的浓度变化为:1.00mol?L-1×0.18=0.18mol/L,则反应在10小时内二氧化碳的平均反应速率为:v(CO2)=
=0.018mol?(L?h)-1,则v(H2)=3v(CO2)=0.054mol?(L?h)-1,
故答案为:0.054;
(2)A、该反应前后气体的质量不变,容器的容积固定,所以混合气体的密度始终不变,故当容器内气体的密度不再改变时,反应不一定达到平衡状态,故A正确;
B、充入氩气增大压强,但是反应体系中各组分的浓度不变,化学平衡不发生移动,所以CO2的转化率不变,故B错误;
C、催化剂不影响化学平衡,所以CO2平衡转化率在上述反应条件下,催化剂Ⅱ与催化剂Ⅰ的转化率相等,故C错误;
D、在上述反应条件下,催化剂Ⅱ的反应速率大于催化剂Ⅰ的,说明催化剂Ⅱ比催化剂Ⅰ的催化效率高,故D正确;
故选AD;
(3)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始浓度(mol/L)1.00 1.60 0 0
变化浓度(mol/L)0.20 0.60 0.20 0.20
平衡浓度(mol/L)0.80 1.0 0.20 0.20
K=
=
L2?mol-2=0.050L2?mol-2,
故答案为:0.050 L2?mol-2;
(4)由于该反应为放热反应,温度增大,化学平衡向着逆向移动,反应物浓度减小,生成物浓度增大,化学平衡常数增大,故平衡常数K(400℃)<K(300℃),
故答案为:<;
| 0.18mol/L |
| 10h |
故答案为:0.054;
(2)A、该反应前后气体的质量不变,容器的容积固定,所以混合气体的密度始终不变,故当容器内气体的密度不再改变时,反应不一定达到平衡状态,故A正确;
B、充入氩气增大压强,但是反应体系中各组分的浓度不变,化学平衡不发生移动,所以CO2的转化率不变,故B错误;
C、催化剂不影响化学平衡,所以CO2平衡转化率在上述反应条件下,催化剂Ⅱ与催化剂Ⅰ的转化率相等,故C错误;
D、在上述反应条件下,催化剂Ⅱ的反应速率大于催化剂Ⅰ的,说明催化剂Ⅱ比催化剂Ⅰ的催化效率高,故D正确;
故选AD;
(3)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始浓度(mol/L)1.00 1.60 0 0
变化浓度(mol/L)0.20 0.60 0.20 0.20
平衡浓度(mol/L)0.80 1.0 0.20 0.20
K=
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| 0.2×0.2 |
| 0.8×1.03 |
故答案为:0.050 L2?mol-2;
(4)由于该反应为放热反应,温度增大,化学平衡向着逆向移动,反应物浓度减小,生成物浓度增大,化学平衡常数增大,故平衡常数K(400℃)<K(300℃),
故答案为:<;
点评:本题考查了化学反应速率、化学平衡常数的计算、影响化学反应速率因素、热化学方程式书写及盖斯定律的应用等知识,题目难度中等,注意掌握化学反应速率、化学平衡常数的表达式及计算方法,明确盖斯定律的含义及其应用方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某恒容密闭容器内发生可逆反应为:2NO2?N2O4,下列状态不能说明该反应达到平衡的标志是( )
| A、平均相对分子质量不再发生改变 |
| B、压强不再发生改变 |
| C、密度不再发生改变 |
| D、容器内的气体的颜色不再变化 |
已知下列实验事实:①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;②将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝;③向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液.下列判断不正确的是( )
| A、化合物KCrO2中元素为+3价 |
| B、实验①证明Cr2O3是两性氧化物 |
| C、实验②证明氧化性:Cr2O72->I2 |
| D、实验③证明H2O2既有氧化性又有还原性 |
下列溶液中有关物质的量浓度关系正确的是( )
| A、25℃时pH=12的NaOH溶液与pH=12的氨水中:c(Na+)>c(NH4+) |
| B、Na2CO3和NaHCO3混合溶液中一定有:2c(CO32-)+c(OH-)+c(HCO3-)=c(H+)+c(Na+) |
| C、pH=4的0.1mol?L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-) |
| D、将①pH=2的CH3COOH溶液、②pH=2的盐酸、③0.01mol/L的氨水、④0.01mol/L的NaOH溶液,分别稀释100倍后溶液中的c(H+):②>①>④>③ |
 叠氮化钠(NaN3)是一种无色晶体,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:
叠氮化钠(NaN3)是一种无色晶体,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:
 A、B、C、D均为中学化学常见物质,且含有一种相同的元素,它们之间有如下转化关系,其中A是单质.
A、B、C、D均为中学化学常见物质,且含有一种相同的元素,它们之间有如下转化关系,其中A是单质.
 关于如图所示①、②两个装置的评价正确的是( )
关于如图所示①、②两个装置的评价正确的是( )