题目内容
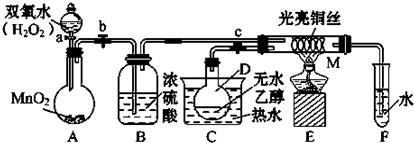
1.某化学课外小组所做实验的示意图如图所示:图中“→”表示所体流向,M是一种纯净而干燥的气体,Y为另一种气体,E内有棕色气体产生,实验所用的物质,只能由下列物质中选取:Na2CO3、Na2O2、NaCl、Na2O、CaCl2、(NH4)2CO3、碱石灰等固体及蒸馏水,据此实验,完成下列填空:
(1)A中所用装置的主要仪器有大(硬质)试管、铁架台(附铁夹)、酒精灯、单孔胶塞和玻璃导管;
(2)B中所选的干燥剂是碱石灰,其作用是吸收二氧化碳和水;
(3)C中发生的主要反应的化学方程式是4NH3+5O2$\frac{\underline{\;pt\;}}{△}$4NO+6H2O;
(4)制取Y气的化学方程式是2Na2O2+2H2O=4NaOH+O2↑;
(5)当F中充有一定量气体后,D停止送气,A停止加热,并立即关闭两个活塞,这时若将F浸入冰水中,可看到F中的现象是颜色变浅,其原因是因为2NO2(g)?N2O4(g)+△H<0,是放热反应,降低温度时平衡向正方向移动,红棕色的NO2部分转变为无色的N2O4,故颜色变浅.
分析 “E内有棕色气体产生”是解答此题的突破点,纯净干燥的气体M和Y气在C中通过灼热铂金丝后,得棕色气体,是一个很明显的现象,中学学过的所有气体中,只有NO2是棕色气体,从本题所限定的反应物中,只能设法从(NH4)2CO3固体获取NO2,由此可以判断C中发生的主要化学反应是氨的铂催化氧化产生的NO继续被氧化,在E中得到棕色NO2气体,所以M和Y两种气体中有一种是NH3,另一种是O2,因为M是固态碳酸盐热分解产生的,而固态碳酸盐热分解不可能生成O2,因此可以得出:M是NH3,Y是O2的结论,据此进行解答.
解答 解:碳酸盐分解干燥后M是一种纯净而干燥的气体,只有(NH4)2CO3分解,M只能氨气,B为碱石灰,Y为另一种气体,当与M气体反应时Y气体过量,E内有棕色气体产生,则C中生成NO,D为氧气,E为NO2,F中含硝酸,
(1)A中加热分解(NH4)2CO3产生氨气,所需要的仪器有:大(硬质)试管、铁架台(附铁夹)、酒精灯、单孔胶塞和玻璃导管,
故答案为:大(硬质)试管、铁架台(附铁夹)、酒精灯、单孔胶塞和玻璃导管;
(2)由上述分析可知,B中所选的干燥剂是碱石灰,作用为吸收二氧化碳和水,
故答案为:碱石灰;吸收二氧化碳和水;
(3)C中发生的主要化学反应是氨的铂催化氧化产生的NO和水,反应化学方程式为:4NH3+5O2$\frac{\underline{\;pt\;}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{\;pt\;}}{△}$4NO+6H2O;
(4)Y为氧气,Na2O2和水反应产生氢氧化钠和氧气,方程式为:2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(5)二氧化氮转化成四氧化二氮的反应为:2NO2(g)?N2O4(g)+△H<0,该反应是放热反应,降低温度时平衡向正方向移动,红棕色的NO2部分转变为无色的N2O4,故颜色变浅,
故答案为:颜色变浅;因为2NO2(g)?N2O4(g)+△H<0,是放热反应,降低温度时平衡向正方向移动,红棕色的NO2部分转变为无色的N2O4,故颜色变浅.
点评 本题考查性质实验方案的设计,为高频考点,题目难度中等,把握物质的性质i实验装置的作用为解答的关键,侧重分析与实验能力的考查,试题培养了学生的分析、理解能力及灵活应用能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案| A. | ④②①③ | B. | ①③②④ | C. | ③②④① | D. | ③④①② |
| 实验操作 | 实验目的 | |
| A | 苯和溴水混合后加入铁粉 | 制溴苯 |
| B | 向工业酒精中加入无水硫酸铜 | 确定工业酒精中是否含有水 |
| C | 电石与水反应,制得的气体直接通入酸性KMnO4溶液 | 检验制得的气体是否为乙炔 |
| D | 将氯乙烷与NaOH溶液共热后冷却,再滴入AgNO3溶液 | 检验氯乙烷中的氯原子 |
| A. | A | B. | B | C. | C | D. | D |
| A. | v(D)=0.4 mol/( L•S ) | B. | v(C)=30 mol/( L•min ) | ||
| C. | v(B)=36 mol/( L•min ) | D. | v(A)=0.15 mol/( L•S ) |
| A. | 小苏打的主要成分是碳酸钠 | |
| B. | NaHCO3的热稳定性小于Na2CO3 | |
| C. | KCl和Na2CO3的固体混合物,加水溶解时有沉淀生成,且沉淀溶于稀盐酸 | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀,其离子方程式可以表示为:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+H2O |
| A. | 将15.6 g Na2O2和5.4 g Al同时放入一定量的水中可以产生标况下气体6.72 L | |
| B. | 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,该气体能使品红溶液褪色,则该溶液可能既含有SO32-又含有CO32- | |
| C. | 大多数碳的化合物都是共价化合物,其原因是碳元素有三种同位素 | |
| D. | 石油分馏可获得乙烯、丙烯和丁二烯 |
 A、B、C、D、E、F是初中化学常见的六种物质,其中A和B、C和D组成的元素种类相同,E是重要的建筑材料,F可用于清除铁锈.它们之间的转化关系如图所示(图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,图中已略去部分物质).回答下列问题:
A、B、C、D、E、F是初中化学常见的六种物质,其中A和B、C和D组成的元素种类相同,E是重要的建筑材料,F可用于清除铁锈.它们之间的转化关系如图所示(图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,图中已略去部分物质).回答下列问题: