题目内容
在醋酸溶液中,加入下列物质不影响醋酸电离平衡的是 ( )
| A、Na |
| B、CaCO3 |
| C、BaCl2 |
| D、NaHSO4 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:在醋酸溶液中,存在电离平衡:CH3COOH?CH3COO-+H+,加入能与醋酸根离子或氢离子反应的离子会促进电离,加入相同的离子会抑制电离,据此分析.
解答:
解:A.存在电离平衡:CH3COOH?CH3COO-+H+,加入Na,与氢离子反应,电离平衡正向移动,故A不选;
B.存在电离平衡:CH3COOH?CH3COO-+H+,加入CaCO3,与氢离子反应,电离平衡正向移动,故B不选;
C.加入BaCl2,对醋酸的电离平衡无影响,故C选;
D.存在电离平衡:CH3COOH?CH3COO-+H+,加入NaHSO4,溶液中的氢离子浓度增大,电离平衡逆向移动,故D不选;
故选C.
B.存在电离平衡:CH3COOH?CH3COO-+H+,加入CaCO3,与氢离子反应,电离平衡正向移动,故B不选;
C.加入BaCl2,对醋酸的电离平衡无影响,故C选;
D.存在电离平衡:CH3COOH?CH3COO-+H+,加入NaHSO4,溶液中的氢离子浓度增大,电离平衡逆向移动,故D不选;
故选C.
点评:本题考查了弱电解质的电离平衡移动,明确影响弱电解质电离平衡移动的因素是解本题关键,题目难度不大.

练习册系列答案
相关题目
下列元素性质的递变规律正确的是( )
| A、第一电离能:B<Be<Mg<Na |
| B、元素的电负性:O>N>S>P |
| C、气态氢化物的稳定性:NH3<CH4<PH3<SiH4 |
| D、原子半径:Be<B<C<N |
已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O.如下图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.下列选项中由实验现象得出的结论完全正确的是( )


| A、滴有KSCN的FeCl2溶液变红色Cl2具有还原性 |
| B、滴有酚酞的NaOH溶液褪色 Cl2具有酸性 |
| C、石蕊溶液先变为红色后褪色Cl2具有漂白性 |
| D、KI淀粉溶液中变蓝色 Cl2具有氧化性 |
制备相同质量的硝酸铜,从经济效益和环保角度考虑,最适宜采用的方法是( )
| A、Cu+HNO3(浓)→Cu(NO3)2 | |||||
| B、Cu+HNO3(稀)→Cu(NO3)2 | |||||
| C、Cu+AgNO3→Cu(NO3)2 | |||||
D、Cu
|
选出下列与浓硫酸的反应活性最高的烯烃( )
A、 |
B、 |
| C、═ |
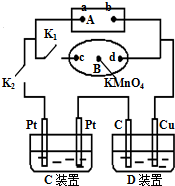 (1)如图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料见图,电解质溶液见已知.
(1)如图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料见图,电解质溶液见已知.