题目内容
6.20世纪80年代中期,科学家发现并证明碳还以新的单质形态C60存在.后来人们又相继得到了C70、C76、C84、C90、C94等另外一些球碳分子.90年代初,科学家又发现了管状碳分子和洋葱状碳分子.(如图):下列说法错误的是( )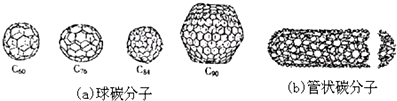
| A. | 金刚石和石墨的熔点肯定要比C60高 | |
| B. | 据估计C60熔点比金刚石和石墨要高 | |
| C. | 无论是球碳分子,还是管状碳分子、洋葱状碳分子,都应看作是碳的同素异形体 | |
| D. | C60的熔点低于C90 |
分析 A.C60属于分子晶体,而金刚石属于原子晶体,石墨属于混合晶体,C60的熔点较低;
B.C60熔点比金刚石和石墨要低;
C.球碳分子、管状碳分子、洋葱状碳分子均是由碳元素形成的结构不同的单质;
D.C60、C90均属于分子晶体,相对分子质量越大,熔点越高.
解答 解:A.金刚石属于原子晶体,石墨属于混合晶体,C60高属于分子晶体,因此金刚石和石墨的熔点肯定要比C60高,故A正确;
B.金刚石属于原子晶体,石墨属于混合晶体,C60高属于分子晶体,因此C60熔点比金刚石和石墨要低,故B错误;
C.球碳分子、管状碳分子、洋葱状碳分子,都是碳元素形成的不同单质,所以均为碳的同素异形体,故C正确;
D.C60、C90均属于分子晶体,C90相对分子质量大,分子间作用力强,熔点较高,故D正确.
故选:B.
点评 本题考查熔沸点高低比较、同素异形体等,比较基础,注意掌握物质熔沸点比较规律,注意石墨的熔点高于金刚石的.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
16.下列对应关系或事实的解释正确的是( )
| A. | NH4Cl水解呈酸性,不能用来当做肥料使用 | |
| B. | 氧化镁的熔点高,可用于制作耐高温的材料 | |
| C. | 氯碱工业中的“碱”指的是Na2CO3 | |
| D. | 水泥、玻璃等硅酸盐材料指的是以二氧化硅为原料生产的材料 |
17.在一定温度下,向2L密闭容器中加入1mol X和2mol Y,发生如下反应:X(g)+2Y(g)?2Z(g),此反应达到平衡的标志是( )
| A. | 容器内气体混合物的密度不随时间变化 | |
| B. | 容器内X、Y、Z浓度之比为1:2:2 | |
| C. | 容器内气体混合物的压强不随时间变化 | |
| D. | 单位时间内消耗0.1mol X,同时生成0.2mol Z |
11.下列物质中,只含有离子键的是( )
| A. | HCl | B. | KOH | C. | CaCl2 | D. | NH4 NO3 |
15.M的名称是乙烯雌酚,它是一种激素类药物,结构简式如图.下列叙述不正确的是( ) 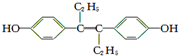

| A. | M的分子式为C18H20O2 | |
| B. | 1 mol M与饱和溴水混合,最多消耗5 mol Br2 | |
| C. | 1 mol M最多能与7 mol H2发生加成反应 | |
| D. | M与NaOH溶液或NaHCO3溶液均能反应 |
16.下列过程需要吸收热量的是( )
| A. | 甲烷在空气中燃烧 | B. | 碳酸钙受热分解 | ||
| C. | 镁条溶于盐酸 | D. | 盐酸与氢氧化钠溶液反应 |
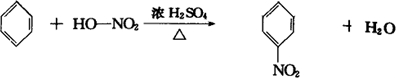

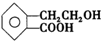 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.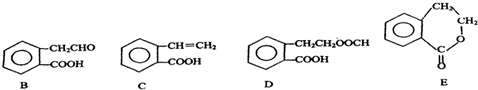
 .
. +2NaOH→
+2NaOH→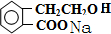 +HCOONa+H2O.
+HCOONa+H2O. .
.