题目内容
下列有关说法正确的是( )
| A、一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 |
| B、N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v (H2)和氢气的平衡转化率均增大 |
| C、升高温度通过降低活化能而加快化学反应速率 |
| D、常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 |
考点:化学平衡的影响因素,焓变和熵变,化学反应速率的影响因素
专题:
分析:A、催化剂不能改变平衡移动;
B、N2(g)+3H2(g)?2NH3(g)△H<0,正反应为放热反应,升温,平衡逆向移动;
C、温度升高使化学反应速率加快的主要原因是活化分子的百分数增加;
D、△H-T△S>0反应非自发进行,反应△S>0,△H>0.
B、N2(g)+3H2(g)?2NH3(g)△H<0,正反应为放热反应,升温,平衡逆向移动;
C、温度升高使化学反应速率加快的主要原因是活化分子的百分数增加;
D、△H-T△S>0反应非自发进行,反应△S>0,△H>0.
解答:
解:A、催化剂只能改变化学反应的速率,对化学平衡不产生影响,故A错误;
B、N2(g)+3H2(g)?2NH3(g)△H<0,正反应为放热反应,升温,平衡逆向移动,反应速率v (H2)增大,氢气的平衡转化率减小,故B错误;
C、温度升高使化学反应速率加快的主要原因是活化分子的百分数增加,增加了反应物分子之间的有效碰撞次数,故C错误;
D、△H-T△S>0,反应非自发进行,反应△S>0,满足△H-T△S>0,则△H>0,故D正确.
故选:D.
B、N2(g)+3H2(g)?2NH3(g)△H<0,正反应为放热反应,升温,平衡逆向移动,反应速率v (H2)增大,氢气的平衡转化率减小,故B错误;
C、温度升高使化学反应速率加快的主要原因是活化分子的百分数增加,增加了反应物分子之间的有效碰撞次数,故C错误;
D、△H-T△S>0,反应非自发进行,反应△S>0,满足△H-T△S>0,则△H>0,故D正确.
故选:D.
点评:本题考查影响化学反应速率和化学平衡的因素,题目难度中等,注意相关基础知识的学习,为解答该类题目的前提.

练习册系列答案
相关题目
下列与化学反应能量变化相关的叙述正确的是( )
| A、2CH3CH2OH(l)+6O2(g)═4CO2(g)+6H2O(l)△H=-1367 kJ/mol,可见乙醇燃烧热△H=-1367 kJ/mol |
| B、放热反应的反应速率总是大于吸热反应的反应速率 |
| C、应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
下列化学用语正确的是( )
A、水的电子式: |
B、氯化钠的电子式: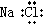 |
| C、KClO3的电离方程式:KClO3=K++Cl-+3O2- |
| D、碳酸氢钠的电离方程式:NaHCO3=Na++HCO3- |
下列离子在给定的条件下一定能大量共存的是( )
| A、pH=1的溶液中:Na+、K+、MnO4-、CO32- |
| B、0.1 mol/L NH4HCO3溶液中:K+、Na+、NO3-、Cl- |
| C、c(Fe3+)=0.1 mol/L的溶液中:NH4+、Cl-、AlO2-、SO42- |
| D、室温下,水电离出的c(H+)=1×10-13mo1/L的溶液中:Mg2+、K+、NO3-、Cl- |
下列物质转化关系中,必须加入适当氧化剂才能实现的是( )
| A、PCl3→PCl5 |
| B、MnO4-→Mn2+ |
| C、SO3→SO42- |
| D、CO2→CO |
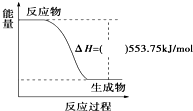 2010年广州亚运会主火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
2010年广州亚运会主火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题: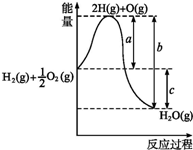 (1)已知:H2(g)+1/2O2(g)═H2O(g),反应过程中能量变化如图所示,则:
(1)已知:H2(g)+1/2O2(g)═H2O(g),反应过程中能量变化如图所示,则: