题目内容
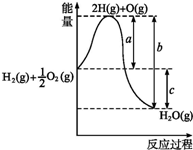 (1)已知:H2(g)+1/2O2(g)═H2O(g),反应过程中能量变化如图所示,则:
(1)已知:H2(g)+1/2O2(g)═H2O(g),反应过程中能量变化如图所示,则:①a、b、c分别代表什么意义?
a
②该反应是
(2)发射“天宫”一号的火箭使用的推进剂是液氢和液氧,这种推进剂的优点是
(3)已知:H2(g)+
| 1 |
| 2 |
H2(g)═H2(l)△H=-0.92kJ?mol-1
O2(g)═O2(l)△H=-6.84kJ?mol-1
H2O(l)═H2O(g)△H=+44.0kJ?mol-1
请写出液氢和液氧生成气态水的热化学方程式:
考点:反应热和焓变,热化学方程式
专题:化学反应中的能量变化
分析:(1)①图象分析可知,化学反应的热效应实质是断裂化学键吸收的热量减去形成化学键放出的热量,所以a表示反应的活化能,b表示的是由2mol H和1mol O形成1mol H2O(g)所放出的能量;c表示的是反应的焓变即反应热;
②依据反应的能量守恒和反应物生成物的能量高低分析判断;
(2)根据氢气燃烧的原理、氢气作为能源的优点分析;
(3)据盖斯定律解答.
②依据反应的能量守恒和反应物生成物的能量高低分析判断;
(2)根据氢气燃烧的原理、氢气作为能源的优点分析;
(3)据盖斯定律解答.
解答:
解:(1)①图象分析可知,化学反应的热效应实质是断裂化学键吸收的热量减去形成化学键放出的热量,所以a表示反应的活化能,b表示活化分子与生成物的能量差;c表示的是反应的焓变即反应热;
故答案为:反应的活化能;活化分子与生成物的能量差;反应热;
②反应物的能量高于生成物,反应是放热反应,焓变小于0,故答案为:放热;<;
(2)氢气在氧气中可以燃烧可以放出大量的热,氢气的燃烧产物是水,不污染环境,故答案为:燃料质量轻;无污染;
(3)已知:①H2(g)+
O2(g)═H2O(l)△H=-285.8kJ?mol-1
②H2(g)═H2(l)△H=-0.92kJ?mol-1
③O2(g)═O2(l)△H=-6.84kJ?mol-1
④H2O(l)═H2O(g)△H=+44.0kJ?mol-1
据盖斯定律,①-②-③
+④得:H2(l)+
O2(l)=H2O(g)△H=-237.46kJ/mol,
故答案为:H2(l)+
O2(l)=H2O(g)△H=-237.46kJ/mol.
故答案为:反应的活化能;活化分子与生成物的能量差;反应热;
②反应物的能量高于生成物,反应是放热反应,焓变小于0,故答案为:放热;<;
(2)氢气在氧气中可以燃烧可以放出大量的热,氢气的燃烧产物是水,不污染环境,故答案为:燃料质量轻;无污染;
(3)已知:①H2(g)+
| 1 |
| 2 |
②H2(g)═H2(l)△H=-0.92kJ?mol-1
③O2(g)═O2(l)△H=-6.84kJ?mol-1
④H2O(l)═H2O(g)△H=+44.0kJ?mol-1
据盖斯定律,①-②-③
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:H2(l)+
| 1 |
| 2 |
点评:本题考查了反应的热量变化的依据和含义、盖斯定律的应用,图象分析、反应实质、能量守恒是解题关键,题目难度中等.

练习册系列答案
相关题目
下列有关说法正确的是( )
| A、一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 |
| B、N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v (H2)和氢气的平衡转化率均增大 |
| C、升高温度通过降低活化能而加快化学反应速率 |
| D、常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 |
有些科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用.下列有关硅的说法中,不正确的是( )
| A、高纯度的硅广泛用于制作计算机 |
| B、硅可由二氧化硅还原制得 |
| C、低温时,硅与水、空气和酸不反应,但能与氢氟酸反应 |
| D、自然界中硅的储量丰富,自然界中存在大量的单质硅 |
甲醇燃料电池(DMFC)可用于笔记本电脑、汽车、遥感通讯设备等,它的一极通入甲醇,一极通入氧气;电解质是质子交换膜,它能传导氢离子(H+).电池工作时,甲醇被氧化为二氧化碳和水,氧气在电极上的反应是O2+4H++4e-═2H2O.下列叙述中不正确的是( )
| A、负极的反应式为CH3OH+H2O-6e-═CO2↑+6H+ |
| B、电池的反应方程式是2CH3OH+3O2═2CO2+4H2O |
| C、电池工作时,H+由正极移向负极 |
| D、电池工作时,电子从通入甲醇的一极流出,经外电路再从通入氧气的一极流入 |
下列实验过程中产生的现象与对应的图形相符的是( )
A、 NaHSO3 粉末加入HNO3溶液中 |
B、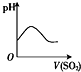 SO2气体通入新制氯水中 |
C、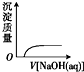 NaOH溶液滴入 Ba(HCO3)2溶液中 |
D、 CO2气体通入澄清石灰水中 |
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示.下列说法中正确的是( )
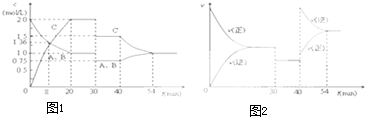

| A、第8min时 A的反应速率为0.08mol?L-1?min-1 |
| B、在0-54分钟的反应过程中该可逆反应的平衡常数始终为4 |
| C、30min时改变的条件是降低温度,40min时改变的条件是升高温度 |
| D、反应方程式中的x=1,且正反应为放热反应 |
已知反应:①101kPa时,C(s)+
O2(g)=CO(g)△H1=-110.5kJ?mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H2=-57.3kJ?mol-1下列结论正确的是( )
| 1 |
| 2 |
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H2=-57.3kJ?mol-1下列结论正确的是( )
| A、若碳的燃烧热用△H3来表示,则△H3<△H1 |
| B、若碳的燃烧热用△H3来表示,则△H3>△H1 |
| C、浓硫酸与稀NaOH溶液反应的中和热为-57.3 kJ?mol-1 |
| D、稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
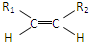
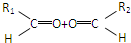
 ③-CH═CH2
③-CH═CH2