题目内容
10.某强酸性溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如图: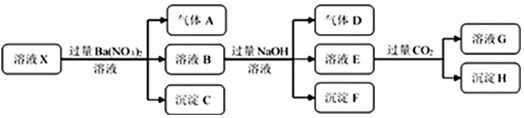
下列有关推断合理的是( )
| A. | 若要确定溶液X中是否含有Fe3+,其操作为取少量原溶液于试管中,加入适量KSCN溶液,溶液变血红色,则含有Fe3+ | |
| B. | 沉淀C为BaSO4,沉淀H为BaCO3 | |
| C. | 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- | |
| D. | 若溶液X为100mL,产生的气体A为112mL(标况),则X中c(Fe2+)=0.05mol•L-1 |
分析 在强酸性溶液中一定不会存在CO32-、SO32-;由实验流程可知,加入过量硝酸钡生成沉淀,则该沉淀C为BaSO4,说明溶液中含有SO42-离子,生成气体A,则A只能是NO,说明溶液中含有还原性离子,则一定为Fe2+离子,溶液B中加入过量NaOH溶液,沉淀F只为Fe(OH)3,生成气体D,则D为NH3,说明溶液中含有NH4+离子;溶液E中通入CO2气体,生成沉淀H,则H为Al(OH)3,E为NaOH和NaAlO2,说明溶液中含有Al3+离子,再根据离子共存知识,溶液中含有Fe2+离子,则一定不含NO3-离子和SO32-离子,含有SO42-离子,则一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,以此来解答.
解答 解:A.上述连续实验不能确定溶液X中是否含有Fe3+,若要确定溶液X中是否含有Fe3+,其操作为取少量原溶液于试管中,加入适量KSCN溶液,溶液变血红色,则含有Fe3+,故A正确;
B.由上述分析可知沉淀C为BaSO4,H为Al(OH)3,BaCO3与过量的二氧化碳生成碳酸氢钡,易溶于水,故B错误;
C.由分析可知,溶液中一定存在:H+、NH4+、Al3+、Fe2+、SO42-,不能确定Cl-是否存在,故C错误;
D.生成气体A的离子反应方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,产生的气体A为112 mL,物质的量为$\frac{0.112L}{22.4L/mol}$=0.005mol,故n(Fe2+)=3×0.005=0.015mol,c(Fe2+)=$\frac{0.015mol}{0.1L}$=0.15mol/L,故D错误;
故选A.
点评 本题考查离子及物质的推断,为高频考点,把握实验流程中发生的反应、离子共存、元素化合物知识为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的综合应用,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 纤维素进入人体内会完全水解为葡萄糖从而为人体提供能量 | |
| B. | 含有食品添加剂的食物对人体均有害 | |
| C. | 硫酸铝可除去水体中的悬浮杂质并起到消毒杀菌的作用 | |
| D. | 含氮、磷元素的化合物大量排入江河湖泊中会导致水体富营养化 |
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO 3- NO 3- OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀:
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出C、D的化学式:CKAl(SO4)2,DCuSO4.
(2)将含1mol A的溶液与含l mol E的溶液反应后蒸干,仅得到一种化合物,请写出A与E反应的离子方程式:HCO3-+OH-=CO32-+H2O.
(3)在A溶液中加入少量澄清石灰水,其离子方程式为2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O.
(4)C常用作净水剂,用离子方程式和适当文字说明其净水原理Al3++3H2O?Al(OH)3(胶体)+3H+,氢氧化铝胶体能吸附水中的悬浮物净水.
(5)若向含溶质0.5mol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为233g.
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
(1)下列物质本身具有的能量最低的是A.
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中最稳定的是A.A.HClB.HBrC.HI
(3)Cl2+H2=2HCl 的反应是B反应.A.吸热反应B.放热反应.
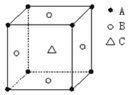 某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为( )
某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为( )| A. | 1:2:1 | B. | 1:3:1 | C. | 2:2:1 | D. | 1:3:3 |
| A. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| B. | 物质燃烧和酸碱中和均放出热量 | |
| C. | 需要加热的反应肯定是吸热反应 | |
| D. | 化学反应是吸热的还是放热的取决于生成物具有的总能量和反应物具有的总能量的相对大小 |
| A. | 李比希 | B. | 维勒 | C. | 凯库勒 | D. | 诺贝尔 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素中,最活泼的金属元素是K.
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3.