题目内容
两瓶NaCl溶液,一瓶NaCl溶液的物质的量浓度为c1 mol/L,密度为ρ1 g/mL;另一瓶NaCl溶液的物质的量浓度为c2 mol/L,密度为ρ2 g/mL,将它们等体积混合后,所得溶液的密度为ρ3 g/mL,则混合后NaCl溶液的物质的量浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:物质的量浓度的相关计算
专题:计算题
分析:令两瓶NaCl溶液的体积都为1L,根据m=ρV计算各溶液质量,再根据n=cV计算各溶液中NaCl的物质的量,根据m=nM计算NaCl质量,计算混合后溶液的质量分数,根据c=
计算混合后溶液物质的量浓度.
| 1000ρw |
| M |
解答:
解:令两瓶NaCl溶液的体积都为1L,
物质的量浓度为c1 mol/L,密度为ρ1 g/mL的 NaCl溶液的质量=1L×1000ρ1 g/L=1000ρ1 g,NaCl的质量=1L×c1 mol/L×58.5g/mol=58.5c1 g,
物质的量浓度为c2 mol/L,密度为ρ12g/mL的 NaCl溶液的质量=1L×1000ρ 2g/L=1000ρ12g,NaCl的质量=1L×c2mol/L×58.5g/mol=58.5c2g,
故混合后溶液质量分数=
,混合后溶液的密度为ρ3 g/mL,故混合后溶液物质的量浓度=
mol/L=
mol/L,
故选B.
物质的量浓度为c1 mol/L,密度为ρ1 g/mL的 NaCl溶液的质量=1L×1000ρ1 g/L=1000ρ1 g,NaCl的质量=1L×c1 mol/L×58.5g/mol=58.5c1 g,
物质的量浓度为c2 mol/L,密度为ρ12g/mL的 NaCl溶液的质量=1L×1000ρ 2g/L=1000ρ12g,NaCl的质量=1L×c2mol/L×58.5g/mol=58.5c2g,
故混合后溶液质量分数=
| 58.5c1+58.5c2 |
| 1000ρ1+1000ρ2 |
1000×ρ3×
| ||
| 58.5 |
| ρ3(c1+c2) |
| ρ1+ρ2 |
故选B.
点评:本题考查物质的量浓度计算,属于字母型计算,增大计算难度,注意对公式的理解与灵活应用,掌握物质的量浓度与质量分数关系,可以利用定义式计算,难度中等.

练习册系列答案
相关题目
将一定质量的NaHCO3分为三等份,第一份直接加入盐酸中,消耗盐酸物质的量为n1,第二份首先加热,使其部分分解后,再加入盐酸中,消耗盐酸物质的量为n2,第三份首先加热,使其完全分解后,再加入盐酸中,消耗盐酸物质的量为n3,假若与盐酸都完全反应,则n1、n2、n3的大小关系正确的是( )
| A、n1=n2=n3 |
| B、n2>n1>n3 |
| C、n1>n2>n3 |
| D、n1>n3>n2 |
“便携式乙醇测量仪”运用燃料电池的工作原理.在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极反应式为:CH3CH2OH+H2O-4e-=X+4H+.下列说法正确的是( )
| A、电池内部H+向负极移动 |
| B、另一极的电极反应式为:O2+4e-+2H2O=4OH- |
| C、X为乙酸 |
| D、乙醇在正极发生反应,电子经过外电路流向负极 |
 实验室中配制碘水,往往是将I2溶于KI溶液中,即可得到浓度较大的碘水,原因是发生了反应:I2(aq)+I-(aq)?I3-(aq).在上述反应的平衡体系中,I3-的物质的量浓度与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).下列说法正确的是( )
实验室中配制碘水,往往是将I2溶于KI溶液中,即可得到浓度较大的碘水,原因是发生了反应:I2(aq)+I-(aq)?I3-(aq).在上述反应的平衡体系中,I3-的物质的量浓度与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).下列说法正确的是( )| A、该反应的正反应为放热反应 |
| B、A状态与C状态的化学反应速率比较为v(A)>v(C) |
| C、在T1、D点状态时,v正<v逆 |
| D、由I2(aq)+I-(aq)?I3-(aq)推知,欲配制浓度较大的氯水,将氯气通入氯化钾溶液即可 |
常温下,下列不发生反应的一组物质是( )
①硅与NaOH溶液 ②硅与盐酸 ③硅与氢氟酸
④二氧化硅与碳酸钠 ⑤二氧化硅与NaOH溶液 ⑥二氧化硅与浓硝酸.
①硅与NaOH溶液 ②硅与盐酸 ③硅与氢氟酸
④二氧化硅与碳酸钠 ⑤二氧化硅与NaOH溶液 ⑥二氧化硅与浓硝酸.
| A、①②④ | B、③④⑥ |
| C、②⑤⑥ | D、②④⑥ |
冶炼下列各组金属时,最适合用H2或CO把它从氧化物中还原出来的是( )
| A、Ca、Mg |
| B、Al、Fe |
| C、Fe、Cu |
| D、Hg、Ag |
 标志垃圾箱的是
标志垃圾箱的是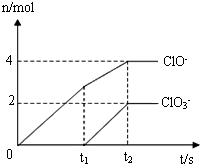 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生反应的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-离子的反应为:6Ca(OH)2+6Cl2=5CaCl2+Ca(ClO3)2+6H2O.
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生反应的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-离子的反应为:6Ca(OH)2+6Cl2=5CaCl2+Ca(ClO3)2+6H2O.