题目内容
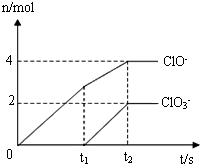 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生反应的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-离子的反应为:6Ca(OH)2+6Cl2=5CaCl2+Ca(ClO3)2+6H2O.
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生反应的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-离子的反应为:6Ca(OH)2+6Cl2=5CaCl2+Ca(ClO3)2+6H2O.试回答:
(1)t2时,Ca(ClO)2与Ca(ClO3)2的物质的量之和为
(2)据分析,生成Ca(ClO3)2的反应是由温度升高引起的,通过氯气的速度不同,ClO-和ClO3-的比例也不同.若在原石灰乳中通入氯气的速度加快,则反应后
| n(ClO-) | ||
n(Cl
|
| n(ClO-) | ||
n(Cl
|
考点:物质的量或浓度随时间的变化曲线
专题:元素周期律与元素周期表专题
分析:(1)由图可知,t2时氢氧化钙与氯气恰好反应,n(C1O-)=4mol,故n[Ca(ClO)2]=2mol,n(C1O3-)=2mol,故n[Ca(ClO3)2]=1mol,根据方程式6Ca(OH)2+6Cl2=5CaCl2+Ca(ClO3)2+6H2O和方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O计算Ca(OH)2的物质的量,进而计算质量;
(2)通入氯气的速率加快,反应速率加快,反应放出的热量无法很快散失,体系温度升高,生成的n(ClO3-)增多;由(1)可知,参加反应的氯气n(Cl2)=n[Ca(OH)2]=5mol,根据氯元素守恒可知,n(ClO-)+n(ClO3-)+n(Cl-)=2n(Cl2)=10mol,若n(ClO-)/n(ClO3-)=a,则an(ClO3-)+n(ClO3-)=10-n(Cl-),根据电子转移守恒有,an(ClO3-)+5n(ClO3-)=n(Cl-),联立方程计算.
(2)通入氯气的速率加快,反应速率加快,反应放出的热量无法很快散失,体系温度升高,生成的n(ClO3-)增多;由(1)可知,参加反应的氯气n(Cl2)=n[Ca(OH)2]=5mol,根据氯元素守恒可知,n(ClO-)+n(ClO3-)+n(Cl-)=2n(Cl2)=10mol,若n(ClO-)/n(ClO3-)=a,则an(ClO3-)+n(ClO3-)=10-n(Cl-),根据电子转移守恒有,an(ClO3-)+5n(ClO3-)=n(Cl-),联立方程计算.
解答:
解:(1)由图可知,t2时氢氧化钙与氯气恰好反应,n(C1O-)=4mol,故n[Ca(ClO)2]=2mol,n(C1O3-)=2mol,故n[Ca(ClO3)2]=1mol,Ca(ClO)2与Ca(ClO3)2的物质的量之和为3mol;根据方程式6Ca(OH)2+6Cl2=5CaCl2+Ca(ClO3)2+6H2O和方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O计算Ca(OH)2的物质的量为2mol×2+1mol×6=10mol,Ca(OH)2的质量为10mol×74g=740g;故答案为:3;740;
(2)通入氯气的速率加快,反应速率加快,反应放出的热量无法很快散失,体系温度升高,生成的n(ClO3-)增多,所以n(ClO-)/n(ClO3-)<2,
由(1)可知,参加反应的氯气n(Cl2)=n[Ca(OH)2]=10mol,根据氯元素守恒可知,n(ClO-)+n(ClO3-)+n(Cl-)=2n(Cl2)=20mol,若n(ClO-)/n(ClO3-)=a,则an(ClO3-)+n(ClO3-)=20-n(Cl-),根据电子转移守恒有,an(ClO3-)+5n(ClO3-)=n(Cl-),联立方程解得,n(Cl-)=
.
故答案为:<;
.
(2)通入氯气的速率加快,反应速率加快,反应放出的热量无法很快散失,体系温度升高,生成的n(ClO3-)增多,所以n(ClO-)/n(ClO3-)<2,
由(1)可知,参加反应的氯气n(Cl2)=n[Ca(OH)2]=10mol,根据氯元素守恒可知,n(ClO-)+n(ClO3-)+n(Cl-)=2n(Cl2)=20mol,若n(ClO-)/n(ClO3-)=a,则an(ClO3-)+n(ClO3-)=20-n(Cl-),根据电子转移守恒有,an(ClO3-)+5n(ClO3-)=n(Cl-),联立方程解得,n(Cl-)=
| 10(a+5) |
| a+3 |
故答案为:<;
| 10(a+5) |
| a+3 |
点评:本题考查氯气性质、图象计算、离子方程式与化学方程式的书写、阅读获得信息的能力等,难度较大,读懂图象与信息判断发生的反应是解题的关键.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
两瓶NaCl溶液,一瓶NaCl溶液的物质的量浓度为c1 mol/L,密度为ρ1 g/mL;另一瓶NaCl溶液的物质的量浓度为c2 mol/L,密度为ρ2 g/mL,将它们等体积混合后,所得溶液的密度为ρ3 g/mL,则混合后NaCl溶液的物质的量浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|