题目内容
 实验室中配制碘水,往往是将I2溶于KI溶液中,即可得到浓度较大的碘水,原因是发生了反应:I2(aq)+I-(aq)?I3-(aq).在上述反应的平衡体系中,I3-的物质的量浓度与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).下列说法正确的是( )
实验室中配制碘水,往往是将I2溶于KI溶液中,即可得到浓度较大的碘水,原因是发生了反应:I2(aq)+I-(aq)?I3-(aq).在上述反应的平衡体系中,I3-的物质的量浓度与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).下列说法正确的是( )| A、该反应的正反应为放热反应 |
| B、A状态与C状态的化学反应速率比较为v(A)>v(C) |
| C、在T1、D点状态时,v正<v逆 |
| D、由I2(aq)+I-(aq)?I3-(aq)推知,欲配制浓度较大的氯水,将氯气通入氯化钾溶液即可 |
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:A、根据温度升高时平衡移动的方向判断反应的反应热;
B、根据A、C状态对应的温度,结合温度对化学反应速率的影响来判断反应速率关系;
C、根据D状态与平衡状态比较,判断反应方向进而得出反应速率关系;
D、根据平衡移动规律来回答判断.
B、根据A、C状态对应的温度,结合温度对化学反应速率的影响来判断反应速率关系;
C、根据D状态与平衡状态比较,判断反应方向进而得出反应速率关系;
D、根据平衡移动规律来回答判断.
解答:
解:A、随着温度的不断升高,I3-的浓度逐渐的减小,说明反应向逆方向移动,I2(aq)+I-(aq)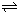 I3-(aq) 是一个放热反应,即△H<0,故A正确;
I3-(aq) 是一个放热反应,即△H<0,故A正确;
B、从图中可知,A点的温度比C点温度低,所以A点与C点的化学反应速率vA<vC,故B错误;
C、从图中可以看出D点并没有达到平衡状态,所以它要向A点移动,I3-的浓度应增加,平衡向正分析移动,所以v正>v逆,故C错误;
D、将氯气通入氯化钾溶液中,会发生类似碘单质的反应:Cl2(aq)+Cl-(aq)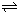 ?Cl3-(aq),c(Cl3-)增大,则c(Cl2)减小,C(Cl-)减小,不能达到目的,故D错误.
?Cl3-(aq),c(Cl3-)增大,则c(Cl2)减小,C(Cl-)减小,不能达到目的,故D错误.
故选A.
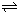 I3-(aq) 是一个放热反应,即△H<0,故A正确;
I3-(aq) 是一个放热反应,即△H<0,故A正确;B、从图中可知,A点的温度比C点温度低,所以A点与C点的化学反应速率vA<vC,故B错误;
C、从图中可以看出D点并没有达到平衡状态,所以它要向A点移动,I3-的浓度应增加,平衡向正分析移动,所以v正>v逆,故C错误;
D、将氯气通入氯化钾溶液中,会发生类似碘单质的反应:Cl2(aq)+Cl-(aq)
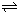 ?Cl3-(aq),c(Cl3-)增大,则c(Cl2)减小,C(Cl-)减小,不能达到目的,故D错误.
?Cl3-(aq),c(Cl3-)增大,则c(Cl2)减小,C(Cl-)减小,不能达到目的,故D错误.故选A.
点评:本题考查化学平衡的移动和平衡常数的运用,注意化学平衡图象分析的一般方法来解答:一看面:看清图象中横坐标和纵坐标的含义;二看线:弄清图象中线的斜率或线走势的意义;三看点:明确曲线的起点、终点、交点及拐点等;四看是否需要辅助线

练习册系列答案
相关题目
可逆反应3A(g)?3B+C;△H>0,随着温度的升高,气体的平均相对分子质量有变小的趋势.下列关于B、C两种物质的聚集状态的判断不正确的是( )
| A、B和C可能都是气体 |
| B、B和C一定都是气体 |
| C、若C为固体,则B一定是气体 |
| D、不可能B为固体,C为气体 |
依据元素周期表及元素周期律,下列推断中正确的是( )
| A、同一周期元素的原子,半径越小越容易失去电子 |
| B、ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| C、向氢硫酸溶液中滴入氯水有单质硫生成,可以验证硫元素的非金属性比氯元素弱 |
| D、主族元素的最高正化合价等于该元素原子的核外电子数 |
有关化学用语正确的是( )
| A、乙烯的结构简式:CH2 CH2 |
| B、乙醇的化学式:C2H6O |
C、CCl4的电子式 |
| D、乙酸的结构简式C2H4O2 |
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中X所处的周期序数与族序数相等.下列说法错 误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中X所处的周期序数与族序数相等.下列说法错 误的是( )| A、Z的氧化物与W的氧化物的化学键类型相同 |
| B、X、Z的氧化物都能溶于氢氧化钠和稀硫酸溶液中 |
| C、最高价氧化物对应水化物稀溶液的氧化性:W<Z |
| D、Y原子的半径比W原子的半径大 |
两瓶NaCl溶液,一瓶NaCl溶液的物质的量浓度为c1 mol/L,密度为ρ1 g/mL;另一瓶NaCl溶液的物质的量浓度为c2 mol/L,密度为ρ2 g/mL,将它们等体积混合后,所得溶液的密度为ρ3 g/mL,则混合后NaCl溶液的物质的量浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列物质中,不属于卤代烃的是( )
| A、CH2Cl2 |
| B、CCl4 |
| C、CCl2F2 |
| D、CH3COCl |
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是( )
| X | Y | |
| Z | W |
| A、原子半径:W>Z>Y>X |
| B、最高价氧化物对应水化物的酸性:Z>W>X |
| C、Z和W的氢化物中,W的氢化物最稳定 |
| D、X的最高价氧化物对应的水化物能与其气态氢化物发生反应 |