题目内容
15.某研究小组为比较Al和Fe的金属性强弱,设计了图1所示的装置,甲中锥形瓶内盛放的是100ml稀盐酸(反应前后溶液体积变化可以忽略不计).
(1)若要比较产生气体的快慢有两种方法,一种是比较产生相同体积气体所需的时间,另一种是比较相同时间内产生气体体积大小;
(2)实验测得产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间内速率逐渐加快说明该反应是放热(填放热或吸热)反应,t2~t3时间内速率逐渐减慢的主要原因是盐酸浓度不断减小;
(3)如果在相同条件下,把甲锥形瓶内盛放稀盐酸改成H+浓度相同的稀硫酸,发现反应会比原来慢许多,原因可能是Cl-会促进该反应的进行,(或SO42-抑制该反应的进行);(写出合理的一种即可)
分析 (1)根据v=$\frac{△V}{△t}$分析;
(2)由外界条件对化学反应速率的影响分析;
(3)盐酸和稀硫酸具有相同的阳离子H+,稀盐酸改成H+浓度相同的稀硫酸,发现反应会比原来慢许多,可能为阴离子的影响.
解答 解:(1)由v=$\frac{△V}{△t}$知,反应速率与气体的体积和时间有关,所以一种是固定体积比较时间,另一种是固定时间比较体积,
故答案为:相同时间内产生气体体积大小;
(2)该反应是一个放热的反应,随着反应的进行,放出的热量越多,溶液的温度越高,温度越高反应速率越大;随着反应的进行,溶液中盐酸的浓度不断减小,浓度越小反应速率越小,
故答案为:放热;盐酸浓度不断减小;
(3)盐酸和稀硫酸具有相同的阳离子H+,稀盐酸改成H+浓度相同的稀硫酸,发现反应会比原来慢许多,可能为Cl-会促进该反应的进行,(或SO42-抑制该反应的进行),
故答案为:Cl-会促进该反应的进行,(或SO42-抑制该反应的进行).
点评 本题考查了化学反应速率的影响因素,外界条件影响化学反应速率,注意决定化学反应速率的是物质本身的性质,题目难度不大.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目
6.下列装置能组成原电池的是( )
| A. |  | B. |  | C. |  | D. |  |
10.下列关于氨及铵盐的性质叙述中,正确的是( )
| A. | 氨气可用排水法收集 | |
| B. | 氯化铵固体加热容易分解 | |
| C. | 氨气和酸相遇都能产生白烟 | |
| D. | 实验室用氢氧化钠溶液和氯化铵溶液加热制NH3 |
20.在容积为672mL的烧瓶里充满NO、NO2(气体所处环境均在标准状况下)的混合气体,将其倒立在水槽里,去塞后再通入280mL氧气,恰好完全反应,且水充满烧瓶(气体体积都已折合为标准状况),下列有关叙述中正确的是( )
| A. | 总反应为NO+NO2+O2+H2O═2HNO3 | |
| B. | 总反应为2NO+10NO2+4O2+6H2O═12HNO3 | |
| C. | 生成硝酸的物质的量浓度接近0.03 mol/L | |
| D. | 生成硝酸的物质的量浓度约为0.045 mol/L |
7.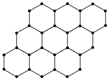 2010年诺贝尔物理学奖用于表彰首次剥离出单层石墨的科学家.单层石墨称为石墨烯,这种“只有一层碳原子厚的碳薄片”的石墨烯,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,应用前景十分广阔!(结构示意图如图所示).下列关于石墨烯的叙述正确的是( )
2010年诺贝尔物理学奖用于表彰首次剥离出单层石墨的科学家.单层石墨称为石墨烯,这种“只有一层碳原子厚的碳薄片”的石墨烯,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,应用前景十分广阔!(结构示意图如图所示).下列关于石墨烯的叙述正确的是( )
 2010年诺贝尔物理学奖用于表彰首次剥离出单层石墨的科学家.单层石墨称为石墨烯,这种“只有一层碳原子厚的碳薄片”的石墨烯,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,应用前景十分广阔!(结构示意图如图所示).下列关于石墨烯的叙述正确的是( )
2010年诺贝尔物理学奖用于表彰首次剥离出单层石墨的科学家.单层石墨称为石墨烯,这种“只有一层碳原子厚的碳薄片”的石墨烯,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,应用前景十分广阔!(结构示意图如图所示).下列关于石墨烯的叙述正确的是( )| A. | 石墨烯可导电,说明它是电解质 | |
| B. | 石墨烯、金刚石、C60都是碳的单质 | |
| C. | 金刚石与石墨烯互为同位素 | |
| D. | ${\;}_{6}^{12}$C与${\;}_{6}^{13}$C为不同的核素,有不同的化学性质 |
4.下列化学式只表示一种纯净物的是( )
| A. | C4H8 | B. | C4H10 | C. | C5H12 | D. | C2H4 |
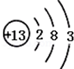 根据如图的原子结构示意图回答下列问题.
根据如图的原子结构示意图回答下列问题. 中填上所需的微粒。
中填上所需的微粒。