题目内容
T℃时,体积相等的甲、乙、丙3个密闭的容器中,发生反应:CO2(g)+H2(g)?CO(g)+H2O(g),起始时充入各物质的物质的量如下表所示( )
则达到平衡时,CO的物质的量由大到小的顺序是.
| CO2 | H2(g) | CO(g) | H2O(g) | |
| 甲 | a mol | a mol | 0 | 0 |
| 乙 | a mol | 2a mol | 0 | 0 |
| 丙 | a mol | a mol | 0 | a mol |
| A、n(甲)>n(乙)>n(丙) |
| B、n(甲)>n(丙)>n(乙) |
| C、n(乙)>n(丙)>n(甲) |
| D、n(乙)>n(甲)>n(丙) |
考点:化学平衡建立的过程
专题:化学平衡专题
分析:由于三个容器体积相同,比较表中的三组数据,以甲的起始量为基础,乙可以看作是在甲的基础上再加amolH2,丙可以看作是在甲的基础上加入amolH2O,根据浓度对平衡的影响加以判断.
解答:
解:由于三个容器体积相同,比较表中的三组数据,以甲的起始量为基础,乙可以看作是在甲的基础上再加amolH2,则平衡向正反应方向移动,所以CO的物质的量乙大于甲,丙可以看作是在甲的基础上加入amolH2O,则平衡向逆反应方向移动,所以CO的物质的量甲大于丙,所以CO的物质的量n(乙)>n(甲)>n(丙),
故选D.
故选D.
点评:本题主要考查了浓度对平衡的影响,难度不大,解题时注意运用等效平衡的思想.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质,根据上述观点,下列说法不正确的是( )
| A、Na2O2的水解产物是NaOH和H2O2 |
| B、NaClO的水解产物之一是HClO |
| C、CCl4的水解产物是CH4和HClO |
| D、CaC2的水解生成C2H2和Ca(OH)2 |
 一定温度下,某密闭容器中存在可逆反应:X?Y+Z,其化学反应速率随时间变化的图象如图所示,其中t1时刻达到平衡,t2时刻缩小容器体积,t3时刻重新达到平衡,下列有关说法不正确的是( )
一定温度下,某密闭容器中存在可逆反应:X?Y+Z,其化学反应速率随时间变化的图象如图所示,其中t1时刻达到平衡,t2时刻缩小容器体积,t3时刻重新达到平衡,下列有关说法不正确的是( )| A、X在该条件下一定不为气体 |
| B、由t1~t3,平衡并未发生移动 |
| C、Y和Z在该条件下至少有一种为气体 |
| D、t1时刻达到平衡时和t3时刻平衡时,气态物质的浓度相同 |
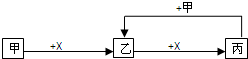 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图(部分产物已略去).下列说法中,正确的是( )
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图(部分产物已略去).下列说法中,正确的是( )| A、若甲为单质铁,则丙一定为FeCl3 |
| B、若甲为强碱,则X一定为CO2 |
| C、若乙是一种白色胶状沉淀,则甲溶液中一定含有Al3+ |
| D、若甲为单质,则此关系中涉及的反应一定都是氧化还原反应 |
如图所示,将铁棒和石墨棒插入1Lmol?L食盐水中,下列说法错误的是( )


| A、若电键K与N连接,铁为负极 |
| B、若电键K与N连接,正极反应式是O2+2H2+4e-═4OH- |
| C、若电键K与M连接,将石墨棒成铜棒,可实现铁棒上镀铜 |
| D、若电键K与M连接,当两极共产生28L(标准状况)气体是,生成了1molNaOH |

 由于工业发展,燃烧设备不断增多,设备规模不断增大.这些工厂排放的烟气中都会有大量的SO2废气.据统计,我国1995年工业SO2的排放量为1396万吨,2006年工业SO2的排放量达到了3800万吨,由于SO2的污染,我国每年损失高达1100亿元.
由于工业发展,燃烧设备不断增多,设备规模不断增大.这些工厂排放的烟气中都会有大量的SO2废气.据统计,我国1995年工业SO2的排放量为1396万吨,2006年工业SO2的排放量达到了3800万吨,由于SO2的污染,我国每年损失高达1100亿元. 向含等物质的量两种溶质的甲溶液逐渐加入乙物质,生成不溶物的量(Y)与加入物的量(X) 之间的关系符合如图所示的是( )
向含等物质的量两种溶质的甲溶液逐渐加入乙物质,生成不溶物的量(Y)与加入物的量(X) 之间的关系符合如图所示的是( )