题目内容
下列关于氢化物的叙述中正确的是( )
| A、稳定性:H2S>HF |
| B、在卤化物中HF最稳定 |
| C、一个D2O分子所含的中子数为8 |
| D、HCl是离子化合物 |
考点:非金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:一般来说,元素的非金属性越强,对应的氢化物越稳定,氢化物大都是共价化合物,结合原子的构成解答该题.
解答:
解:A.非金属性F>S,HF稳定性较强,故A错误;
B.卤族元素从上到下,元素的非金属性逐渐减弱,对应的氢化物的稳定性逐渐减弱,则卤化物中HF最稳定,故B正确;
C.一个D2O分子所含的中子数为2×1+8=10,故C错误;
D.HCl为共价化合物,故D错误.
故选B.
B.卤族元素从上到下,元素的非金属性逐渐减弱,对应的氢化物的稳定性逐渐减弱,则卤化物中HF最稳定,故B正确;
C.一个D2O分子所含的中子数为2×1+8=10,故C错误;
D.HCl为共价化合物,故D错误.
故选B.
点评:本题考查元素周期律知识,为高频考点,侧重于基本概念的理解和运用的考查,注意把握元素周期律的递变规律,难度不大.

练习册系列答案
相关题目
如图所示,将铁棒和石墨棒插入1Lmol?L食盐水中,下列说法错误的是( )


| A、若电键K与N连接,铁为负极 |
| B、若电键K与N连接,正极反应式是O2+2H2+4e-═4OH- |
| C、若电键K与M连接,将石墨棒成铜棒,可实现铁棒上镀铜 |
| D、若电键K与M连接,当两极共产生28L(标准状况)气体是,生成了1molNaOH |
卤素单质F2、Cl2、Br2、I2的密度的变化规律是( )
| A、逐渐增大 | B、逐渐减小 |
| C、不变 | D、没有规律 |
根据元素周期表和元素周期律分析下面的推断,其中错误的是( )
| A、镁的原子失电子能力比钠弱 |
| B、氟的氢化物很稳定 |
| C、硫的氢化物比氧的氢化物更不稳定 |
| D、氢氧化钠是弱碱 |
碱金属元素钠的电子层数是( )
| A、一层 | B、二层 | C、三层 | D、四层 |
下列解释事实的化学方程式或离子方程式,不正确的是( )
A、工业上可用电解法制备Mg:MgCl2
| ||||
| B、自然界中正常的雨水呈酸性:H2O+CO2?H2CO3?H++HCO3- | ||||
| C、用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq) | ||||
| D、用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+Fe2++14H+═2Cr3++Fe3++7H2O |
50g镁、锌、铁的混合物与足量的稀硫酸反应得到混合溶液,蒸发得到218g固体(换算为无水硫酸盐).则反应产生氢气的质量是( )
| A、3.5g | B、3g |
| C、2g | D、4.5g |
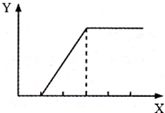 向含等物质的量两种溶质的甲溶液逐渐加入乙物质,生成不溶物的量(Y)与加入物的量(X) 之间的关系符合如图所示的是( )
向含等物质的量两种溶质的甲溶液逐渐加入乙物质,生成不溶物的量(Y)与加入物的量(X) 之间的关系符合如图所示的是( ) 下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.