题目内容
13.一定条件下,向两个容积相同的密闭容器中分别充入一定量的NO2(g)和NH3(g),分别达到平衡2NO2?N2O4,2NH3?N2+3H2,均为气态后,NO2和NH3的转化率均为a%,保持温度、容积不变,向两个容器中分别再充入1molN2O4和1molNH3,再次达到平衡时NO2和NH3的转化率分别为b%和c%.则下列关系中正确的是( )| A. | b>a>c | B. | c>a>b | C. | a>b>c | D. | a=b=c |
分析 在两个恒容容器中有平衡体系:①2NO2?N2O4,②2NH3?N2+3H2,向两个容器中分别再充入1molN2O4和1molNH3,相当于增大体系的压强,平衡向气体体积减小的方向进行,以此来解答.
解答 解:在两个恒容容器中有平衡体系:①2NO2?N2O4,②2NH3?N2+3H2,平衡时NO2和NH3的转化率均为a%,
若向容器中①再充入1molN2O4,①向正反应方向移动,促进反应物的转化,则再次达到平衡时NO2为b%>a%;
②中再充入1molNH3,②向逆反应方向移动,转化率减小,则再次达到平衡时NH3的转化率为c%<a%,
故选A.
点评 本题考查化学平衡移动,为高频考点,把握恒容时物质的量的增大相当于压强增大为解答的关键,注意压强增大平衡向体积缩小的方向移动,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
14.将一定量的钠铝合金置于水中,合金全部溶解,往溶液中加入1mol/L盐酸20mL,此时沉淀量达到最大值,则原合金中钠的质量为( )
| A. | 0.80g | B. | 0.02g | C. | 0.23g | D. | 0.46g |
18.在2L的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)该反应为吸热反应(选填“吸热”、“放热”).反应达平衡后,若再通入一定量CO2,则平衡常数K将不变,CO2的转化率减小.(填“增大”、“减小”或“不变”)
(3)能判断该反应是否达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)若 600℃时,向容器中充入1mol CO、1mol H2O,反应达到平衡后,CO的转化率是$\frac{2}{3}$.
CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 600 | 800 | 830 | 1000 | 1200 |
| K | 0.25 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)该反应为吸热反应(选填“吸热”、“放热”).反应达平衡后,若再通入一定量CO2,则平衡常数K将不变,CO2的转化率减小.(填“增大”、“减小”或“不变”)
(3)能判断该反应是否达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)若 600℃时,向容器中充入1mol CO、1mol H2O,反应达到平衡后,CO的转化率是$\frac{2}{3}$.

 有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证反应实质.实验时,往100mL大试管中先加40mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入FeSO4溶液使煤油的液面至胶塞,并夹紧弹簧夹(如图),仔细观察,回答下列问题:
有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证反应实质.实验时,往100mL大试管中先加40mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入FeSO4溶液使煤油的液面至胶塞,并夹紧弹簧夹(如图),仔细观察,回答下列问题: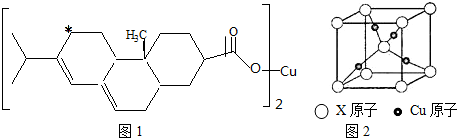
 ,晶体密度为8.5g/cm3,求晶胞的边长(只写计算式,不求结果).$\root{3}{\frac{257}{8.5{N}_{A}}}$.
,晶体密度为8.5g/cm3,求晶胞的边长(只写计算式,不求结果).$\root{3}{\frac{257}{8.5{N}_{A}}}$.