题目内容
 实验室制配0.5mol/L的NaOH溶液500mL.
实验室制配0.5mol/L的NaOH溶液500mL.(1)配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀⑤转移 ⑥洗涤 ⑦定容 ⑧冷却.其正确的操作顺序为
(2)试分析下列操作对所配溶液的浓度有何影响
①定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,对所配溶液浓度的影响
②某同学观察液面的情况如图所示,则所配置的溶液的浓度
(3)取出其中50mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:(1)据配制溶液的实验操作过程进行实验步骤排序.(2)根据实验操作对物质的量浓度c=
产生的影响进行判断;(3)根据稀释定律,稀释前后溶质氢氧化钠的物质的量不变,据此计算稀释后所得氢氧化钠溶液的浓度.
| n |
| V |
解答:
解:(1)配制0.5mol?L-1的NaOH溶液500mL,配制步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,用天平称量NaOH(用到药匙),在烧杯中稀释,并用玻璃棒搅拌,加速溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,并将洗涤液移入容量瓶,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所以操作顺序是②①③⑧⑤⑥⑦④.
故答案为:②①③⑧⑤⑥⑦④.
(2)①定容、加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度线,导致溶液的体积偏大,浓度偏低;
②定容时俯视刻度线,导致溶液的体积偏小,浓度偏高;
故答案为:偏低,偏高;
(3)根据稀释定律,稀释前后溶质氢氧化钠的物质的量不变,令稀释后的浓度为c,则:
0.05L×0.5mol/L=0.1L×c,
解得c=0.25mol/L,
故答案为:0.25mol/L.
所以操作顺序是②①③⑧⑤⑥⑦④.
故答案为:②①③⑧⑤⑥⑦④.
(2)①定容、加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度线,导致溶液的体积偏大,浓度偏低;
②定容时俯视刻度线,导致溶液的体积偏小,浓度偏高;
故答案为:偏低,偏高;
(3)根据稀释定律,稀释前后溶质氢氧化钠的物质的量不变,令稀释后的浓度为c,则:
0.05L×0.5mol/L=0.1L×c,
解得c=0.25mol/L,
故答案为:0.25mol/L.
点评:本题考查了配制有的物质的量浓度的溶液的方法及误差分析,题目难度不大,要求学生掌握配制一定物质的量浓度的溶液的步骤及误差分析的方法与技巧.

练习册系列答案
相关题目
下列试剂加入少量溴水充分振荡后,上层几乎无色的是( )
| A、己烷 | B、溴苯 | C、乙醇 | D、甲苯 |
下列事实不能用勒夏特列原理解释的是( )
| A、工业制取金属钾:Na(l)+KCl(l)?NaCl(l)+K(g),选取适宜的温度,使K成蒸汽从反应混合物中分离出来 |
| B、开启啤酒瓶时,有大量泡沫状气泡涌出瓶口 |
| C、工业合成氨气,采用铁触媒,并在500℃进行反应 |
| D、对于2HI(g)?H2(g)+I2(g);△H>0,升高温度可使颜色变深 |
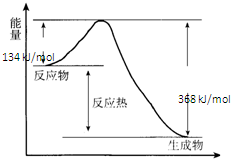 在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如图所示.
在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如图所示.