题目内容
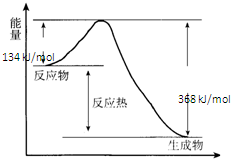 在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如图所示.
在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如图所示.(1)该反应是
(2)该反应的热化学方程式为
(3)改变下列条件都可使该反应的反应速率改变,其中通过降低活化能加快反应速率的是
a.浓度 b.压强 c.温度 d.催化剂
(4)反应体系中加入催化剂对反应热是否有影响?
考点:反应热和焓变,吸热反应和放热反应,热化学方程式
专题:化学反应中的能量变化
分析:(1)据图分析,反应物能量高于生成物;
(2)书写热化学方程式时注意标出物质的状态,并且注意△H是生成物和反应物的能量差;
(3)催化剂能降低反应的活化能;
(4)△H=生成物能量-反应物能量,与反应条件无关.
(2)书写热化学方程式时注意标出物质的状态,并且注意△H是生成物和反应物的能量差;
(3)催化剂能降低反应的活化能;
(4)△H=生成物能量-反应物能量,与反应条件无关.
解答:
解:(1)据图分析,反应物能量高于生成物,反应放热,故答案为:放热;
(2)△H=生成物与反应物能量差=134KJ/mol-368KJ/mol=-234KJ/mol,其热化学方程式为:NO2(g)+CO(g) NO(g)+CO2(g)△H=-234 kJ?mol-1
NO(g)+CO2(g)△H=-234 kJ?mol-1
故答案为:NO2(g)+CO(g) NO(g)+CO2(g)△H=-234 kJ?mol-1;
NO(g)+CO2(g)△H=-234 kJ?mol-1;
(3)催化剂能降低反应的活化能,浓度、压强通过增大活化分子的浓度加快反应速率,温度是增大活化分子百分数增大反应速率,故选:d;
(4)反应体系中加催化剂,对反应热没有影响,因为,催化剂只能改变化学反应的速率和途径,不能改变化学反应始态和终态的能量,因此对反应热没有影响,故答案为:否;催化剂只能改变化学反应的速率和途径,不能改变化学反应始态和终态的能量,因此对反应热没有影响.
(2)△H=生成物与反应物能量差=134KJ/mol-368KJ/mol=-234KJ/mol,其热化学方程式为:NO2(g)+CO(g)
 NO(g)+CO2(g)△H=-234 kJ?mol-1
NO(g)+CO2(g)△H=-234 kJ?mol-1故答案为:NO2(g)+CO(g)
 NO(g)+CO2(g)△H=-234 kJ?mol-1;
NO(g)+CO2(g)△H=-234 kJ?mol-1;(3)催化剂能降低反应的活化能,浓度、压强通过增大活化分子的浓度加快反应速率,温度是增大活化分子百分数增大反应速率,故选:d;
(4)反应体系中加催化剂,对反应热没有影响,因为,催化剂只能改变化学反应的速率和途径,不能改变化学反应始态和终态的能量,因此对反应热没有影响,故答案为:否;催化剂只能改变化学反应的速率和途径,不能改变化学反应始态和终态的能量,因此对反应热没有影响.
点评:本题根据反应物键能和生成物键能解答问题,考查内容比较基础,题目难度不大.

练习册系列答案
相关题目
下面有关14C和14N的叙述正确的是( )
| A、14C与14N有相同的中子数 |
| B、C与C60互为同位素 |
| C、15N与14N互为同位素 |
| D、14C与14N是相同的核素 |
对可逆反应A(气)+2B(气)?2C(气)△H<0的平衡体系,下列说法错误的是( )
| A、使用催化剂,v正、v逆都改变,变化的倍数相同 |
| B、升高温度,v正、v逆都增大,v正增大的倍数小于v逆增大的倍数 |
| C、增大压强,v正、v逆反应的速率都增大,v正增大的倍数大于v逆增大的倍数 |
| D、降低温度,v正、v逆都减小,v正减小的倍数大于v逆减小的倍数 |
按照无机物的分类方法,下列各组物质中,属于不同类型的物质是( )
| A、火碱、烧碱、生石灰 |
| B、生石灰、冰、干冰 |
| C、熟石灰、苛性钠、氢氧化钾 |
| D、纯碱、硫酸钠、胆矾 |
 实验室制配0.5mol/L的NaOH溶液500mL.
实验室制配0.5mol/L的NaOH溶液500mL. 氮氧化物是空气的主要污染物,消除氮氧化物污染有多种方法.用催化技术可将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO?2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
氮氧化物是空气的主要污染物,消除氮氧化物污染有多种方法.用催化技术可将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO?2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
 、
、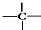 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示.例如:
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示.例如: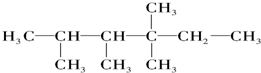 分子中,n1=6、n2=1、n3=2、n4=1.试根据不同烷烃的组成结构,分析出烷烃(除甲烷外)中各原子数的关系.
分子中,n1=6、n2=1、n3=2、n4=1.试根据不同烷烃的组成结构,分析出烷烃(除甲烷外)中各原子数的关系.