题目内容
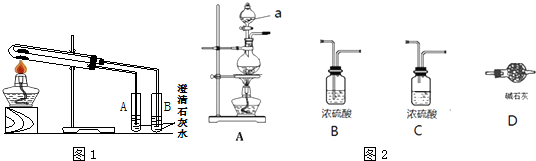
5.(1)为比较Na2CO3和NaHCO3的热稳定性,某同学设计了如图1实验装置.实验时,先检查装置的气密性,再取少量Na2CO3粉末加在大试管的底部,另取少量NaHCO3粉末加在小试管底部.预热后在大试管底部加热.①开始加热一段时间后,试管B(填“A”或“B”)中会出现浑浊现象.
②实验现象证明,加热条件下,Na2CO3比NaHCO3更稳定(填“稳定”或“不稳定”).
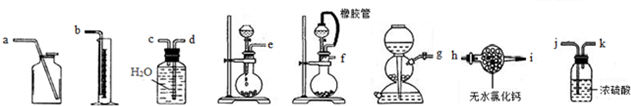
(2)实验室用MnO2和浓盐酸反应制取Cl2,发生装置如图2A.
回答下列问题:
①仪器a的名称是分液漏斗.写出A中反应的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
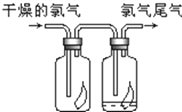
②制得的气体除去HCl杂质后,为得到干燥的Cl2,应通过B装置(填“B”“C”或“D”).
分析 (1)比较Na2CO3和NaHCO3的热稳定性,碳酸氢钠加热分解,而碳酸钠加热不分解,由图1可知,为体现对比,小试管中为碳酸氢钠;
(2)用MnO2和浓盐酸反应制取Cl2,分液漏斗中为浓盐酸,烧瓶中为二氧化锰,加热时发生MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,除去氯气中的HCl后,用浓硫酸干燥氯气,最后利用碱吸收尾气,以此来解答.
解答 解:(1)碳酸氢钠加热分解,而碳酸钠加热不分解,则
①少量NaHCO3粉末加在小试管底部,加热时分解生成二氧化碳,则B中石灰水变浑浊,故答案为:B;
②实验现象证明,加热条件下,Na2CO3比NaHCO3更稳定,故答案为:稳定;
(2)①由图可知,仪器a为分液漏斗,A中反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
②制得的气体除去HCl杂质后,为得到干燥的Cl2,用浓硫酸干燥,导管长进短出,则应通过B装置,故答案为:B.
点评 本题考查物质的性质和制备实验,为高频考点,把握物质的性质、反应原理、实验装置的作用及实验技能为解答的关键,侧重分析与实验能力的考查,注意套管实验的对比作用,题目难度不大.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
13.下列物质的分子中,共用电子对数目最多的是( )
| A. | N2 | B. | NH3 | C. | H2O | D. | CH4 |
20.现有含CaO杂质的CaC2试样.某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度.请填写下列空白:
(1)第一种方案:请从图中选用适当的装置,设计一个实验,测定CaC2试样的纯度.所选装置的连接顺序为(按气流方向,用接口字母表示):fcdb.若实验时称取的试样为 m g,产生的乙炔在标准状况下的体积为n mL,此试样中CaC2的质量分数为$\frac{64n}{22400m}$×100%.
(2)第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数.先称取试样6.80g、锥形瓶和水的质量为188.00g,再将试样加入锥形瓶中,用电子天平称量,实验装置如图所示.反应过程中每隔相同时间测得的数据如表:
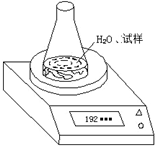
①不必作第六次读数的原因是第4、5次试验读数相同,表明锥形瓶内质量已达恒定反应进行完全.
②有同学认为用此装置测得的数据比真实值小,试分析原因:水蒸气随C2H2挥发.
③如何在原有装置上进行改进,使结果更加准确.请简要描述你的方案:在锥形瓶口添加一个带有无水氯化钙的干燥管的单孔橡皮塞.
(3)第三种方案:称取6.80g试样,用200mL 1.85mol/L的稀盐酸溶解,将所得的溶液转移至500mL容量瓶中,定容.取20mL定容后的溶液,用0.20mol/L的NaOH溶液滴定至终点,消耗NaOH溶液30.00mL,则6.80g试样中CaC2的质量为5.12g.

(1)第一种方案:请从图中选用适当的装置,设计一个实验,测定CaC2试样的纯度.所选装置的连接顺序为(按气流方向,用接口字母表示):fcdb.若实验时称取的试样为 m g,产生的乙炔在标准状况下的体积为n mL,此试样中CaC2的质量分数为$\frac{64n}{22400m}$×100%.
(2)第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数.先称取试样6.80g、锥形瓶和水的质量为188.00g,再将试样加入锥形瓶中,用电子天平称量,实验装置如图所示.反应过程中每隔相同时间测得的数据如表:

| 锥形瓶+水+试样 | |||||
| 读数次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 质量/g | 192.80 | 192.30 | 192.10 | 192.00 | 192.00 |
②有同学认为用此装置测得的数据比真实值小,试分析原因:水蒸气随C2H2挥发.
③如何在原有装置上进行改进,使结果更加准确.请简要描述你的方案:在锥形瓶口添加一个带有无水氯化钙的干燥管的单孔橡皮塞.
(3)第三种方案:称取6.80g试样,用200mL 1.85mol/L的稀盐酸溶解,将所得的溶液转移至500mL容量瓶中,定容.取20mL定容后的溶液,用0.20mol/L的NaOH溶液滴定至终点,消耗NaOH溶液30.00mL,则6.80g试样中CaC2的质量为5.12g.
17.实验室有镁铝合金0.05mol,将其完全溶于100mL 1mol/L的H2SO4溶液中,再逐滴加入1mol/L氨水,当溶液中沉淀质量不再变化时,整个过程中至少需滴加氨水的体积为( )
| A. | 100mL | B. | 200mL | C. | 220mL | D. | 240mL |
14.将X气体通入Y溶液中,实验结果与预测的现象一致的组合是( )
| 选项 | X气体 | Y溶液 | 预测的现象 |
| ① | CO2 | BaCl2溶液 | 白色沉淀析出 |
| ② | SO2 | Ba(N03)2溶液 | 白色沉淀析出 |
| ③ | Cl2 | AgNO3溶液 | 白色沉淀析出 |
| ④ | NH3 | FeCl2溶液 | 白色沉淀产生 |
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
15.下列每个选项的甲乙两个反应中,属于同一种反应类型的是( )
| 选项 | 甲 | 乙 |
| A | 溴乙烷水解制备乙醇 | 乙烯水化制备乙醇 |
| B | 甲烷与氯气反应制备四氯化碳 | 乙烯通入KMnO4溶液中 |
| C | 甲苯与KMnO4溶液反应生成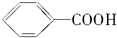 | 苯与液溴反应制备溴苯 |
| D | 蛋白质水解得到氨基酸 | 乙醇与冰醋酸反应生成乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |
 (1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式,并用双线桥画出电子转移的方向和数目.
(1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式,并用双线桥画出电子转移的方向和数目.