题目内容
13.玉兔号月球车在发射时,运载火箭共装有推进剂[燃料(C2H8N2)和助燃剂(N2O4)]共420t,点燃两者若恰好反应生成CO2、N2和H2O.反应的化学方程式为C2H8N2+2N2O4$\frac{\underline{\;点燃\;}}{\;}$4H2O+2CO2↑+3N2↑,其中燃料C2H8N2的物质的量为1.72×106(mol)(保留三位有效数字)分析 (C2H8N2)和助燃剂(N2O4)]反应生成二氧化碳、水和氮气,依据原子个数守恒配平方程式,依据n=$\frac{m}{M}$计算燃料C2H8N2的物质的量.
解答 解:(C2H8N2)和助燃剂(N2O4)]反应生成二氧化碳、水和氮气,依据质量守恒定律化学反应前后原子的种类和数目不变,反应的方程式:C2H8N2+2N2O4 $\frac{\underline{\;点燃\;}}{\;}$4H2O+2CO2↑+3 N2↑,
因二者恰好反应,则C2H8N2占反应物质量比为:$\frac{60}{60+184}$×100%=24.59%,则420t混合物中含有C2H8N2物质的量为:$\frac{420×1000000×24.59%}{60}$=1.72×106(mol);
故答案为:C2H8N2+2N2O4 $\frac{\underline{\;点燃\;}}{\;}$4H2O+2CO2↑+3 N2↑;1.72×106(mol);
点评 本题考查了有关方程式的书写及物质的量相关计算,把握反应中原子个数守恒,明确以物质的量为核心的计算公式是解题关键,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
10. 常温下,向20.00ml0.1000mol•L-1(NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )
常温下,向20.00ml0.1000mol•L-1(NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )
 常温下,向20.00ml0.1000mol•L-1(NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )
常温下,向20.00ml0.1000mol•L-1(NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )| A. | 点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+) | |
| B. | 点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) | |
| C. | 点c所示溶液中:c(SO42-)+c(H+)=c(NH3•H2O)+c(OH-) | |
| D. | 点d所示溶液中:c(SO42-)>c(NH3•H2O)>c(NH4+)>c(OH-) |
18.下列实验所对应的现象和离子方程式正确的是( )
| 实验 | 现象 | 离子方程式 | |
| A | 苯酚钠溶液中通入少量CO2 | 产生白色浑浊 | 2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
| B | 在少量稀碳酸钠溶液中逐滴加入稀盐酸至过量. | 开始无气泡,后来有气泡. | CO32-+H+→HCO3- HCO3-+H+→CO2↑+H2O |
| C | 将过量氯化铝溶液逐滴加入到氢氧化钠溶液中 | 先产生白色沉淀而后逐渐溶解 | Al3++3OH-→Al(OH)3↓ Al(OH)3+OH-→AlO2-+H2O |
| D | 向含有酚酞的氢氧化钡溶液中滴加稀硫酸 | 产生白色沉淀,溶液由红色变成无色. | Ba2++OH+H++SO42-→BaSO4↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
5.向容积恒为5L的密闭容器中加入5mol SO2、2.5mol O2和0.5mol SO3,在500℃的温度和催化剂作用下发生反应:2SO2+O2$?_{△}^{催化剂}$2SO3经过amin后SO3的物质的量稳定于4.5mol而不变.下列叙述错误的是( )
| A. | SO3的物质的量为4.5mol的状态为平衡状态 | |
| B. | O2的平均反应速率为0.4amol•(L•min)-1 | |
| C. | SO2和O2的反应百分率相等 | |
| D. | 达到化学平衡状态时容器内压强减小 |
2.某化学小组用如图所示装置制取氯气,下列说法不正确的是( )
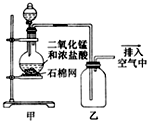

| A. | 该装置图中至少存在两处明显错误 | |
| B. | 烧瓶中的MnO2可换成KMnO4 | |
| C. | 在乙后连一盛有饱和食盐水的烧杯可进行尾气处理 | |
| D. | 在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出 |
3.以下物质分离提纯(括号里为杂质)所用试剂正确的是( )
| A. | 乙酸乙酯(乙酸):水 | |
| B. | 溴苯(溴):NaOH溶液 | |
| C. | 苯(苯酚):浓溴水 | |
| D. | 苯(甲苯):酸性高锰酸钾溶液、NaOH溶液 |