��Ŀ����
 �״���CH3OH���Ͷ����ѣ�CH3OCH3������Ϊ21���͵�����ȼ�ϣ�������ࡢ�{Ч�����������ܣ�
�״���CH3OH���Ͷ����ѣ�CH3OCH3������Ϊ21���͵�����ȼ�ϣ�������ࡢ�{Ч�����������ܣ���1 ��CO2�����ںϳɶ����ѣ�CH3OCH3�����йط�Ӧ���Ȼ�ѧ����ʽ���£�
CO2��g��+3H2��g��=CH3OH��g��+H20��g����H=-49.0kJ?mol-1
2CH3OH��g��=CH30CH3��g��+H20��g����H=-23.5kJ?mol-1
��CO2��H2��Ӧ�ϳɶ����ѵ��Ȼ�ѧ����ʽΪ
��2 ������Ӧ2CH3OH��g��?CH3OCH3��g��+H20��g����ij�¶��µĻ�ѧƽ�ⳣ��Ϊ400�����¶��£����ܱ������м���һ�����״�����Ӧ���е�ijʱ�̣���ø����ʵ�Ũ�������ʾ��
���� | CH3OCH3��g�� | H20��g�� | |
| Ũ�ȣ�mol?L-1�� | 0.60 | 0.60 |
��������״���10min��Ӧ�ﵽƽ�ᣬ��ƽ���c��CH3OH��=
��3 ����ҵ�Ϻϳɼ״��ķ�Ӧ��CO��g��+2H2��g��?CH3OH��g����H=-90.8kJ?mol-1�����¶���ͬ���ݻ���2L��3�������У�����ͬ��ʽͶ�˷�Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���£�
| ���� | ��2 | �� | �� |
| ��Ӧ��Ͷ���� | 1molCO��2molH2 | 1molCH3OH | 2molCO��4molH2 |
| CH3OH | c1=0.25 | c2 | c3 |
| ��Ӧ�������仯 | �ų�Q1kJ | ����Q2kJ | �ų�Q3kJ |
| ƽ�ⳣ�� | K1 | K2 | K3 |
| ��Ӧ��ת���� | a1 | a2 | a3 |
A��v����H2��=2v����CH3OH��
B��n��CO����n��H2����n��CH3OH��=1��2��1
C�����������ܶȲ���
D����������ƽ����Է�����������
E��������ѹǿ����
������˵����ȷ����
A��c1=c2 B��Q1=Q2 C��K1=K2 D��a2+a3��100%
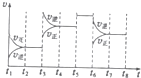
����ͼ��ʾ�÷�Ӧ�ķ�Ӧ����v��ʱ��t�Ĺ�ϵͼ��
���ε�ƽ�ⳣ�����±���ʾ��
| t1-t2 | t4-t5 | t5-t6 | t7-t8 |
| K4 | K5 | K6 | K7 |
���㣺��Чƽ��,�Ȼ�ѧ����ʽ,��ѧƽ���Ӱ������,��ѧƽ��״̬���ж�
ר�⣺��ѧ��Ӧ�е������仯,��ѧƽ��ר��
��������1�����ݸ�˹���ɼ������Ȼ�ѧ����ʽд��CO2��H2��Ӧ�ϳɶ����ѵ��Ȼ�ѧ����ʽ��
��2���ٸ��ݸ���ֵ�Ũ������ƽ�ⳣ���Ĵ�С�����жϷ�Ӧ�������淴Ӧ���ʴ�С��
����ﵽƽ��ʱ��������xmol�״�����������ʽ��ƽ�ⳣ���г�����ʽ���м���ƽ��ʱ�״�Ũ�ȼ������ѵķ�Ӧ���ʣ�
��3���ٿ��淴Ӧ�ﵽƽ��״̬��һ���������淴Ӧ������ȣ�����ֵ�Ũ�ȡ��ٷֺ������ٱ仯���ݴ˽����жϣ�
���ں��º��������£�����1molCO��2molH2������1molCH3OHΪ��Чƽ�⣬�����м���2molCO��4molH2�������ȣ���������ѹǿ��ƽ�����������ƶ����ݴ˽��н��
���¶Ȳ��䣬��ѧƽ�ⳣ�����䣬t3ʱ�̣����淴Ӧ���ʶ��������淴Ӧ���ʱ仯��ƽ�����淴Ӧ�ƶ���Ӧ��Ϊ�������¶ȣ�t6ʱ�̣����淴Ӧ���ʶ���С��������Ӧ���ʱ仯��ƽ�����淴Ӧ�ƶ����ݴ˽��н��
��2���ٸ��ݸ���ֵ�Ũ������ƽ�ⳣ���Ĵ�С�����жϷ�Ӧ�������淴Ӧ���ʴ�С��
����ﵽƽ��ʱ��������xmol�״�����������ʽ��ƽ�ⳣ���г�����ʽ���м���ƽ��ʱ�״�Ũ�ȼ������ѵķ�Ӧ���ʣ�
��3���ٿ��淴Ӧ�ﵽƽ��״̬��һ���������淴Ӧ������ȣ�����ֵ�Ũ�ȡ��ٷֺ������ٱ仯���ݴ˽����жϣ�
���ں��º��������£�����1molCO��2molH2������1molCH3OHΪ��Чƽ�⣬�����м���2molCO��4molH2�������ȣ���������ѹǿ��ƽ�����������ƶ����ݴ˽��н��
���¶Ȳ��䣬��ѧƽ�ⳣ�����䣬t3ʱ�̣����淴Ӧ���ʶ��������淴Ӧ���ʱ仯��ƽ�����淴Ӧ�ƶ���Ӧ��Ϊ�������¶ȣ�t6ʱ�̣����淴Ӧ���ʶ���С��������Ӧ���ʱ仯��ƽ�����淴Ӧ�ƶ����ݴ˽��н��
���
�⣺��1����g��+3H2��g��=CH3OH��g��+H20��g����H=-49.0kJ?mol-1 ��
2CH3OH��g��=CH30CH3��g��+H20��g����H=-23.5kJ?mol-1��
���ݸ�˹���ɣ����١�2+�ڿɵã�2CO2��g��+6H2��g���TCH3OCH3��g��+3H2O��g����H=-121.5kJ?mol-1��
�ʴ�Ϊ��2CO2��g��+6H2��g���TCH3OCH3��g��+3H2O��g����H=-121.5kJ?mol-1��
��2���ٴ�ʱ��Ũ����Ϊ��Qc=
=1.86��400���ʷ�Ӧ������Ӧ������У�����Ӧ���ʴ����淴Ӧ���ʣ�
�ʴ�Ϊ������
����ﵽƽ��ʱ�ݴ���������xmol����
2CH3OH��g���PCH3OCH3��g��+H2O��g��
ijʱ��Ũ�ȣ�mol?L-1����0.44 0.6 0.6
ת��Ũ�ȣ�mol?L-1����2x x x
ƽ��Ũ�ȣ�mol?L-1����0.44-2x 0.6+x 0.6+x
K=
=400�����x=0.2mol/L��
��ƽ��ʱc��CH3OH��=0.44mol/L-0.2mol/L��2=0.04mol/L��
��10min���ɶ����ѵ�Ũ��Ϊ��0.6moL/L+0.2moL/L=0.8mol/L��
���Լ״��ķ�Ӧ����Ϊv��CH3OH��=
=0.08 mol/��L?min����
�ʴ�Ϊ��0.040 mol?L-1��0.08 mol?L-1?min-1��
��3����A��v����H2��=2v����CH3OH������ʾ�������淴Ӧ���ʣ����������������ϵ��˵����Ӧ�ﵽƽ��״̬����A����
B��n��CO����n��H2����n��CH3OH��=1��2��1�����ʵ���֮�ȣ����ж����淴Ӧ�����Ƿ���ȣ����ж��Ƿ�ﵽƽ��״̬����B��ȷ��
C�����������ܶȲ��䣬��Ӧǰ�������壬�������ݻ����䣬����������ܶ�ʼ�ղ��䣬�ܶȲ�����Ϊ�ж�ƽ��״̬�����ݣ���C��ȷ��
D���÷�Ӧ�����������С�ķ�Ӧ����Ӧ��������������ʵ��������仯����������ƽ�������������仯������������ƽ����Է����������䣬˵���ﵽ��ƽ��״̬����D����
E���÷�Ӧ�������С�ķ�Ӧ����������ʵ����ڷ�Ӧ�з����仯����������ѹǿ���䣬˵�����淴Ӧ������ȣ��ﵽ��ƽ��״̬����E����
�ʴ�Ϊ��BC��
��A�����º��������£�����1molCO��2molH2������1molCH3OHΪ��Чƽ�⣬��ﵽƽ��ʱ����ֵ�Ũ�ȶ���ȣ�����c1=c2����A��ȷ��
B�����ڼ����ǴӲ�ͬ������еķ�Ӧ����ų��������������յ�������һ����ȣ���B����
C�����ڼ���Ϊ�Ӳ�ͬ�ķ�����еĿ��淴Ӧ��������Ӧ���¶���ͬ����ƽ�ⳣ�����䣬����K1=K2����C��ȷ��
D������Ϊ��Чƽ�⣬��Ӧ�ķ�����ȫ��ͬ������a1=a2�����ڱ���Ũ��Ϊ��2�����൱��������ѹǿ�����з�Ӧ��ת���ʴ��ڼף���a3��a1������a2+a3��100%����D����
�ʴ�Ϊ��AC��
��t3ʱ�̣����淴Ӧ���ʶ��������淴Ӧ���ʱ仯��ƽ�����淴Ӧ�ƶ���ӦΪ�����¶ȣ�����K4��K5��
t6ʱ�̣����淴Ӧ���ʶ���С��������Ӧ���ʱ仯��ƽ�����淴Ӧ�ƶ���ӦΪ����ѹǿ������K6=K7��
t5��t6�������ʶ�����ƽ�ⲻ�ƶ���Ӧ��ʹ�ô�����K���䣬����K5=K6������K4��K5=K6=K7��
����t3ʱ���������¶ȣ�ƽ�����������ƶ�����Ӧ��ת���ʼ�С��t4-t5ʱʹ�ô�����ת���ʲ��䣻t6ʱ��С��ѹǿ��ƽ�����������ƶ�����Ӧ��ת���ʼ�С������t2��t3��A��ת������ߣ�
�ʴ�Ϊ��K4��K5=K6=K7�� t2��t3��
2CH3OH��g��=CH30CH3��g��+H20��g����H=-23.5kJ?mol-1��
���ݸ�˹���ɣ����١�2+�ڿɵã�2CO2��g��+6H2��g���TCH3OCH3��g��+3H2O��g����H=-121.5kJ?mol-1��
�ʴ�Ϊ��2CO2��g��+6H2��g���TCH3OCH3��g��+3H2O��g����H=-121.5kJ?mol-1��
��2���ٴ�ʱ��Ũ����Ϊ��Qc=
| 0.6��0.6 |
| 0.442 |
�ʴ�Ϊ������
����ﵽƽ��ʱ�ݴ���������xmol����
2CH3OH��g���PCH3OCH3��g��+H2O��g��
ijʱ��Ũ�ȣ�mol?L-1����0.44 0.6 0.6
ת��Ũ�ȣ�mol?L-1����2x x x
ƽ��Ũ�ȣ�mol?L-1����0.44-2x 0.6+x 0.6+x
K=
| (0.6+x)2 |
| (0.44-2x)2 |
��ƽ��ʱc��CH3OH��=0.44mol/L-0.2mol/L��2=0.04mol/L��
��10min���ɶ����ѵ�Ũ��Ϊ��0.6moL/L+0.2moL/L=0.8mol/L��
���Լ״��ķ�Ӧ����Ϊv��CH3OH��=
| 0.8mol/L |
| 10min |
�ʴ�Ϊ��0.040 mol?L-1��0.08 mol?L-1?min-1��
��3����A��v����H2��=2v����CH3OH������ʾ�������淴Ӧ���ʣ����������������ϵ��˵����Ӧ�ﵽƽ��״̬����A����
B��n��CO����n��H2����n��CH3OH��=1��2��1�����ʵ���֮�ȣ����ж����淴Ӧ�����Ƿ���ȣ����ж��Ƿ�ﵽƽ��״̬����B��ȷ��
C�����������ܶȲ��䣬��Ӧǰ�������壬�������ݻ����䣬����������ܶ�ʼ�ղ��䣬�ܶȲ�����Ϊ�ж�ƽ��״̬�����ݣ���C��ȷ��
D���÷�Ӧ�����������С�ķ�Ӧ����Ӧ��������������ʵ��������仯����������ƽ�������������仯������������ƽ����Է����������䣬˵���ﵽ��ƽ��״̬����D����
E���÷�Ӧ�������С�ķ�Ӧ����������ʵ����ڷ�Ӧ�з����仯����������ѹǿ���䣬˵�����淴Ӧ������ȣ��ﵽ��ƽ��״̬����E����
�ʴ�Ϊ��BC��
��A�����º��������£�����1molCO��2molH2������1molCH3OHΪ��Чƽ�⣬��ﵽƽ��ʱ����ֵ�Ũ�ȶ���ȣ�����c1=c2����A��ȷ��
B�����ڼ����ǴӲ�ͬ������еķ�Ӧ����ų��������������յ�������һ����ȣ���B����
C�����ڼ���Ϊ�Ӳ�ͬ�ķ�����еĿ��淴Ӧ��������Ӧ���¶���ͬ����ƽ�ⳣ�����䣬����K1=K2����C��ȷ��
D������Ϊ��Чƽ�⣬��Ӧ�ķ�����ȫ��ͬ������a1=a2�����ڱ���Ũ��Ϊ��2�����൱��������ѹǿ�����з�Ӧ��ת���ʴ��ڼף���a3��a1������a2+a3��100%����D����
�ʴ�Ϊ��AC��
��t3ʱ�̣����淴Ӧ���ʶ��������淴Ӧ���ʱ仯��ƽ�����淴Ӧ�ƶ���ӦΪ�����¶ȣ�����K4��K5��
t6ʱ�̣����淴Ӧ���ʶ���С��������Ӧ���ʱ仯��ƽ�����淴Ӧ�ƶ���ӦΪ����ѹǿ������K6=K7��
t5��t6�������ʶ�����ƽ�ⲻ�ƶ���Ӧ��ʹ�ô�����K���䣬����K5=K6������K4��K5=K6=K7��
����t3ʱ���������¶ȣ�ƽ�����������ƶ�����Ӧ��ת���ʼ�С��t4-t5ʱʹ�ô�����ת���ʲ��䣻t6ʱ��С��ѹǿ��ƽ�����������ƶ�����Ӧ��ת���ʼ�С������t2��t3��A��ת������ߣ�
�ʴ�Ϊ��K4��K5=K6=K7�� t2��t3��
���������⿼���Ϊ�ۺϣ���Ŀ�Ѷ��еȣ��������������ѶȽϴ�ע�⡰ʼ��ת��ƽ���ǽ���йػ�ѧƽ��ġ������ۡ����ⷨ����������һ��ȷ�������Խ���й�ƽ���ƽ�ⳣ�����㡢ת���ʡ���Ӧ���ʡ�ƽ��ʱ�ɷֵ���������ȵĹؼ���

��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ
��NAΪ����٤����������ֵ��������������ȷ���ǣ�������
| A��1mol NH3�����е�ԭ����ΪNA |
| B�����³�ѹ�£�22.4L����������ԭ����Ϊ3NA |
| C�����³�ѹ�£�48gO2��O3�Ļ�����к��е���ԭ����Ϊ3NA |
| D��1mol/L��NaCl��Һ������Na+ΪNA |
һ������ȼ�ϵ�أ�������Ϊ�缫����KOH��Һ�У��ֱ�������ͨ�����飨C2H6��������������ijһ�缫��ӦʽΪC2H6+18OH--14e-�T2CO32-+12H2O���йش˵�ص��ƶϲ���ȷ���ǣ�������
| A��ͨ�������ĵ缫Ϊ���� |
| B���μӷ�Ӧ��O2��C2H6�����ʵ���֮��Ϊ7��2 |
| C���ŵ�һ��ʱ���KOH�����ʵ���Ũ�Ƚ��½� |
| D���ŵ�һ��ʱ���������������Һ��pH��С |
ʵ�飺����ʢ��1mL 0.1mol/L MgCl2��Һ�Թ��м�1mL 0.2mol/L NaOH��Һ���õ���Һa�����˵õ���Һb�Ͱ�ɫ����c��
�������c�еμ�0.1mol/L FeCl3��Һ��������Ϊ���ɫ��
���з�������ȷ���ǣ�������
�������c�еμ�0.1mol/L FeCl3��Һ��������Ϊ���ɫ��
���з�������ȷ���ǣ�������
| A����Һa�д��ڳ����ܽ�ƽ�⣺Mg��OH��2��s���TMg2+��aq��+2OH-��aq�� |
| B����Һb�в�����Mg2+ |
| C��������ɫ�仯˵��Mg��OH��2ת��ΪFe��OH��3 |
| D��ʵ�����֤��Fe��OH��3��Mg��OH��2������ |

