题目内容
15.锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌.某硫化锌精矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示: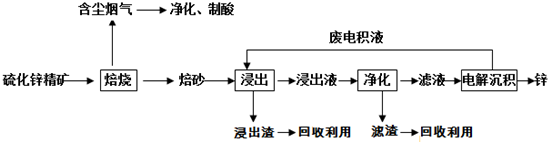
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为ZnO.
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的浸出操作.
(3)浸出液“净化”过程中加入的主要物质为锌粉,其作用是置换出Fe等,反应的离子方程式为Zn+Fe2+=Zn2++Fe.
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是O2.
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质.“氧压酸浸”中发生的主要反应的离子方程式为2ZnS+4H++O2=2Zn2++2S↓+2H2O.
(6)硫化锌精矿(ZnS)遇到硫酸铜溶液可慢慢地转变为铜蓝(CuS).请用简短的语言解释该反应发生的原理在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物(或在相同条件下,由于KSP(CuS)小于KSP(ZnS),故反应可以发生).
(7)我国古代曾采用“火法”工艺冶炼锌.明代宋应星著的《天工开物》中有关于“升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,…,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…,冷淀,毁罐取出,…,即倭铅也.”该炼锌工艺过程主要反应的化学方程式为ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑.(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
分析 硫化锌精矿的焙烧可生成ZnO、氧化铁等,含尘烟气含有含硫氧化物,可用于制备硫酸,浸出液加入硫酸可生成硫酸锌、硫酸铁,加入过量锌充分反应,可置换出铁,滤液中主要含有硫酸锌,经电解可得到锌和硫酸,电解液中含有硫酸,可循环利用;
(1)含锌矿的主要成分是ZnS,与空气中氧气发生氧化还原反应,判断焙砂的主要成分为氧化锌;
(2)焙烧生成的含硫氧化物可转换为硫酸;
(3)该含锌矿中还含有FeS等杂质,浸出操作后转化为亚铁离子,可加入锌粉出去亚铁离子,从而除去Fe;
(4)电解沉积过程中,是电解ZnSO4,阳极上是氢氧根离子失电子发生氧化反应;
(5)“氧压酸浸”法顾名思义,可知反应物中含有H+和O2,可以获得非金属单质S,根据反应物和生成物写出化学方程式;
(6)根据沉淀的转化原理可知,在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物;
(7)根据题目描述可知反应物为ZnCO3和C,产物含有Zn,根据反应物和生成物写出化学方程式.
解答 解:硫化锌精矿的焙烧可生成ZnO、氧化铁等,含尘烟气含有含硫氧化物,可用于制备硫酸,浸出液加入硫酸可生成硫酸锌、硫酸铁,加入过量锌充分反应,可置换出铁,滤液中主要含有硫酸锌,经电解可得到锌和硫酸,电解液中含有硫酸,可循环利用;
(1)硫化锌精矿的主要成分为ZnS(还含少量FeS等其他成分),含锌矿的主要成分是ZnS,与空气中氧气发生氧化还原反应,则焙砂的主要成分为ZnO,
故答案为:ZnO;
(2)流程图分析可知,焙烧生成的含硫氧化物可转换为硫酸,用于后续的浸出操作,
故答案为:浸出;
(3)该含锌矿中还含有FeS等杂质,浸出操作后转化为亚铁离子,可加入锌粉出去亚铁离子,从而除去Fe,反应的离子方程式为Zn+Fe2+=Zn2++Fe,
故答案为:置换出Fe等;Zn+Fe2+=Zn2++Fe;
(4)电解沉积过程中,是电解ZnSO4,阴极锌离子放电生成锌,阳极发生氧化反应,产物为O2,故答案为:O2;
(5)“氧压酸浸”法顾名思义,可知反应物中含有H+和O2,可以获得非金属单质S,写出化学方程式为:2ZnS+4H++O2=2Zn2++2S↓+2H2O;
故答案为:2ZnS+4H++O2=2Zn2++2S↓+2H2O;
(6)根据沉淀的转化原理可知,在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物,所以硫化锌精矿(ZnS)遇到硫酸铜溶液可慢慢地转变为铜蓝(CuS),
故答案为:在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物(或在相同条件下,由于KSP(CuS)小于KSP(ZnS),故反应可以发生);
(7)根据题目描述可知反应物为ZnCO3和C,产物含有Zn,则化学方程式为ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑,故答案为:ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑.
点评 本题难度中等,掌握氧化物的特征、利用化合价的原则计算指定元素的化合价的方法、化学方程式的书写方法、含杂质物质的化学方程式的计算等是正确解答本题的关键.

| A. | Z的氢化物的沸点是同主族元素中最高的 | |
| B. | 由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒只有2种 | |
| C. | 仅由X、Y两种元素组成的化合物不止一种 | |
| D. | X和Z可以组成原子个数比分别为1:1和2:1常温下为液态的两种化合物 |
| A. | N2+O2═2NO | B. | N2+3H2═2NH3 | ||
| C. | 2NO+O2═2NO2 | D. | 3NO2+H2O═2HNO3+NO↑ |
| A. | 铁在潮湿的空气中易发生吸氧腐蚀生成Fe(OH)2,进一步被O2氧化为Fe(OH)3,Fe(OH)3脱去一部分水生成Fe2O3•nH2O,它就是铁锈的主要成分 | |
| B. | 分子筛中有许多笼状空穴和通道可用于分离、提纯气体,还可用作干燥剂、离子交换剂、催化剂和、催化剂载体 | |
| C. | 俄国化学家门捷列夫经过研究提出了元素周期律--元素性质随着元素原子量(相对原子质量)递增而呈周期性变化的规律,并列出第一张元素周期表 | |
| D. | 氧化铝陶瓷、硅藻土、沸石、立方氮化硼都是无机非金属材料,光导纤维、聚酯纤维、橡胶、酚醛树脂都是高分子材料 |
| A. | 已知 N2(g)+3H2 (g)═2NH3(g)△H=-92.4 kJ•mol-1,当有 1molNH3时,上述反应的△H 变为-46.2 kJ•mol-1 | |
| B. | 1mol 羟基(-OH)与 17gNH3所含电子数都为NA | |
| C. | 由 8.0gCH3COONa 和少量 CH3COOH 形成的中性溶液中,CH3COO-数目为0.1NA | |
| D. | 常温常压下,7.1gCl2与足量的Fe粉反应转移的电子数为0.2NA |
| A. | 向NaAlO2溶液中通入过量CO2:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| B. | NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | Cu溶于稀硝酸HNO3:Cu+2H++NO3-═Cu2++NO↑+H2O |
 ,丙的电子式为
,丙的电子式为 ,E在周期表中的位置为第三周期VA族.
,E在周期表中的位置为第三周期VA族. +O2+xOH-
+O2+xOH- Fe3O4↓+S4O
Fe3O4↓+S4O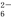 +2H2O。
+2H2O。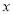 =____________.
=____________.