题目内容
9.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )| A. | 1mol/LNaCl溶液含有NA个Na+ | |
| B. | 任意条件下,16gO3所含的原子数为NA | |
| C. | 1molFe与足量稀HNO3反应,转移3NA个电子 | |
| D. | 标准状况下,22.4LSO3所含的分子数为NA |
分析 A.溶液体积未知;
B.臭氧是由氧原子构成,依据N=$\frac{m}{M}$×NA计算解答;
C.铁与足量稀硝酸反应生成三价铁离子;
D.标况下,三氧化硫不是气体.
解答 解:A.溶液体积未知,不能计算钠离子个数,故A错误;
B.臭氧是由氧原子构成,则16g臭氧含有氧原子个数=$\frac{m}{M}$×NA=$\frac{16g}{16g/mol}$×NA=NA,故B正确;
C.铁与足量稀硝酸反应生成三价铁离子,1molFe与足量稀HNO3反应,生成1mol三价铁离子,转移3NA个电子,故C正确;
D.标况下,三氧化硫不是气体,不能使用气体摩尔体积,故D错误;
故选:BC.
点评 本题考查了阿伏伽德罗常数的分析应用,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,注意气体摩尔体积使用条件和对象.

练习册系列答案
相关题目
19.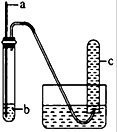 用如图装置进行实验,下列预期实验现象及相应结论均正确的是( )
用如图装置进行实验,下列预期实验现象及相应结论均正确的是( )
 用如图装置进行实验,下列预期实验现象及相应结论均正确的是( )
用如图装置进行实验,下列预期实验现象及相应结论均正确的是( )| a | b | 预期实验 现象 | 结论 | |
| A | 铜丝 | 浓硝酸 | 试管c中有大量红棕色气体 | 硝酸有强氧化性 |
| B | 木条 | 18.4mol/L 硫酸 | 木条变黑 | 浓硫酸有酸性及 氧化性 |
| C | 生铁 | NaCl溶液 | 导管处发生倒吸 | 生铁发生吸氧腐蚀 |
| D | 铁丝 | 含少量HCl的H2O2溶液 | 试管c中有大量无色气体 | 该反应中铁作催化剂 |
| A. | A | B. | B | C. | C | D. | D |
20.下列说法不正确的是( )
| A. | 铁在潮湿的空气中易发生吸氧腐蚀生成Fe(OH)2,进一步被O2氧化为Fe(OH)3,Fe(OH)3脱去一部分水生成Fe2O3•nH2O,它就是铁锈的主要成分 | |
| B. | 分子筛中有许多笼状空穴和通道可用于分离、提纯气体,还可用作干燥剂、离子交换剂、催化剂和、催化剂载体 | |
| C. | 俄国化学家门捷列夫经过研究提出了元素周期律--元素性质随着元素原子量(相对原子质量)递增而呈周期性变化的规律,并列出第一张元素周期表 | |
| D. | 氧化铝陶瓷、硅藻土、沸石、立方氮化硼都是无机非金属材料,光导纤维、聚酯纤维、橡胶、酚醛树脂都是高分子材料 |
4.下列指定反应的离子方程式正确的是( )
| A. | 向NaAlO2溶液中通入过量CO2:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| B. | NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | Cu溶于稀硝酸HNO3:Cu+2H++NO3-═Cu2++NO↑+H2O |
14.已知正四面体形分子E和直线型分子F反应,生成四面体形分子L和直线型分子M.(组成E分子的元素的原子序数小于10,组成F分子的元素为第三周期的元素.)如图,则下列判断中正确的是 ( )


| A. | 常温常压下,L是一种液态有机物 | B. | E中化学键是极性键 | ||
| C. | F具有漂白性 | D. | 上述反应的类型是取代反应 |
18.下列操作中,未考虑“化学反应速率影响因素”的是( )
| A. | 实验室由乙醇生成乙烯,温度控制在170℃而不是140℃ | |
| B. | 高锰酸钾溶液与H2C2O4反应时加入MnSO4 | |
| C. | 铜与浓硫酸反应时将铜丝绕成螺旋状 | |
| D. | 实验室制备乙炔时用饱和食盐水代替水 |
 的合成路线(部分反应条件略去)如图所示:
的合成路线(部分反应条件略去)如图所示:
 +
+ $\stackrel{△}{→}$
$\stackrel{△}{→}$ ,R-C≡N$→_{ii.HCl}^{i.NaOH}$R-COOH,
,R-C≡N$→_{ii.HCl}^{i.NaOH}$R-COOH, ,D→E的反应类型为取代反应或水解反应;
,D→E的反应类型为取代反应或水解反应; ;
; 中最多有10个原子共平面,
中最多有10个原子共平面, 发生缩聚反应生成有机物的结构简式为
发生缩聚反应生成有机物的结构简式为 ;
; (写结构简式).
(写结构简式).