题目内容
 一氧化碳是一种用途相当广泛的化工基础原料.
一氧化碳是一种用途相当广泛的化工基础原料.(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍.
Ni(s)+4CO(g)
| 50-80℃ |
| 180-200℃ |
(2)在高温下一氧化碳可将二氧化硫还原为单质硫.已知:
C(s)+O2(g)═CO2(g);△H1=-393.5kJ?mol-1
CO2(g)+C(s)═2CO(g);△H2=+172.5kJ?mol-1
S(s)+O2(g)═SO2(g);△H3=-296.0kJ?mol-1
则2CO(g)+SO2(g)═S(s)+2CO2(g)△H3=
(3)工业上一般采用CO与H2反应合成可再生能源甲醇,反应如下:CO(g)+2H2(g)?CH3OH(g)
①某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol?L-1,则CO的转化率为
②合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160.此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol?L-1) | 0.2 | 0.1 | 0.4 |
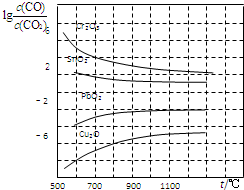
(4)金属氧化物被一氧化碳还原生成金属单质和二氧化碳.如图是四种金属氧化物被一氧化碳还原时lg
| c(CO) |
| c(CO2) |
K=
考点:用盖斯定律进行有关反应热的计算,化学平衡常数的含义,化学平衡的计算
专题:化学反应中的能量变化,化学平衡专题
分析:(1)根据大多数的化合反应为放热反应,放热反应的△H<0;
(2)利用盖斯定律可以根据已知的反应的热化学方程式求反应2CO+SO2=S+2CO2的焓变,进而写热化学方程式;
(3)①转化率=
,根据平衡浓度计算出平衡常数来确定温度;
②计算此时的浓度商Qc,与平衡常数比较,判断反应进行的方向,据此解答;根据氢气的浓度计算甲醇的浓度变化量,再根据v=
计算v(CH3OH);合成气进行循环,可以提高原料利用率;
(4)一氧化碳和三氧化铬生成铬和二氧化碳,根据得失电子守恒得其反应方程式为:Cr2O3+3CO
2Cr+3CO2,该反应中只有二氧化碳和一氧化碳为气体,所以其K=
;化学平衡常数越大说明该反应越容易进行,根据化学平衡常数判断;
(2)利用盖斯定律可以根据已知的反应的热化学方程式求反应2CO+SO2=S+2CO2的焓变,进而写热化学方程式;
(3)①转化率=
| n(CO)(反应) |
| n(CO)(反应开始) |
②计算此时的浓度商Qc,与平衡常数比较,判断反应进行的方向,据此解答;根据氢气的浓度计算甲醇的浓度变化量,再根据v=
| △c |
| △t |
(4)一氧化碳和三氧化铬生成铬和二氧化碳,根据得失电子守恒得其反应方程式为:Cr2O3+3CO
| ||
| c 3(CO2) |
| c 3(CO) |
解答:
解:(1)反应Ni(s)+4CO(g)  Ni(CO)4(g)为化合反应,大多数的化合反应为放热反应,放热反应的△H<0,故答案为:<;
Ni(CO)4(g)为化合反应,大多数的化合反应为放热反应,放热反应的△H<0,故答案为:<;
(2)根据盖斯定律,反应2CO+SO2=S+2CO2的焓变=△H1-△H2-△H3=-270 kJ?mol-1,故答案为:-270 kJ?mol-1
(3)①平衡时一氧化碳的物质的量=0.2mol/L×2L=0.4mol,转化率=
=
×100%=80%,故答案为:80%;
②由表中数据可知,10min时氢气的浓度为0.2mol/L、CO的浓度为0.1mol/L、甲醇的浓度为0.4mol/L,则此时的浓度商Qc=
=100,小于平衡常数160,故反应向正反应方向进行,故V正>V逆;由表中数据可知,l0min内氢气的浓度变化量为(1-0.4)mol/L=0.6mol/L,故甲醇的浓度变化量为0.3mol/L,故v(CH3OH)=
=0.03mol/(L?min),
生产过程中,合成气要进行循环,这样可以提高原料利用率,
故答案为:>;0.03mol/(L?min);提高原料利用率(或提高产量、产率亦可);
(4)一氧化碳还原三氧化铬反应的化学方程式为:3CO(g)+Cr2O3(s)
2Cr(s)+3CO2(g),则K=
;
800℃时,K越大,金属氧化物越易被还原,故Cu2O越易被还原,故lg
=-6,则K=106,
故答案为:
;Cu2O;106.
 Ni(CO)4(g)为化合反应,大多数的化合反应为放热反应,放热反应的△H<0,故答案为:<;
Ni(CO)4(g)为化合反应,大多数的化合反应为放热反应,放热反应的△H<0,故答案为:<;(2)根据盖斯定律,反应2CO+SO2=S+2CO2的焓变=△H1-△H2-△H3=-270 kJ?mol-1,故答案为:-270 kJ?mol-1
(3)①平衡时一氧化碳的物质的量=0.2mol/L×2L=0.4mol,转化率=
| n(CO)(反应) |
| n(CO)(反应开始) |
| (1-0.4)mol |
| 2mol |
②由表中数据可知,10min时氢气的浓度为0.2mol/L、CO的浓度为0.1mol/L、甲醇的浓度为0.4mol/L,则此时的浓度商Qc=
| 0.4 |
| 0.22×0.1 |
| 0.3mol/L |
| 10min |
生产过程中,合成气要进行循环,这样可以提高原料利用率,
故答案为:>;0.03mol/(L?min);提高原料利用率(或提高产量、产率亦可);
(4)一氧化碳还原三氧化铬反应的化学方程式为:3CO(g)+Cr2O3(s)
| ||
| c 3(CO2) |
| c 3(CO) |
800℃时,K越大,金属氧化物越易被还原,故Cu2O越易被还原,故lg
| 1 |
| K |
故答案为:
| c 3(CO2) |
| c 3(CO) |
点评:本题是一道热化学和化学平衡影响因素、化学平衡常数等计算问题,题目综合性强,关键抓住化学平衡计算的三段式法,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
化学与生活密切相关.下列说法中不正确的是( )
| A、塑料、橡胶、纤维都是有机高分子化合物 |
| B、核电站泄露的放射性物质131I和127I互为同位素,化学性质相似 |
| C、以NO和NO2为主的氮氧化物是形成光化学烟雾和酸雨的一个重要原因 |
| D、氢氧化铁胶体、含PM2.5(是指大气中直径接近于2.5×10-5m的细颗粒物)的大气均具有丁达尔效应 |

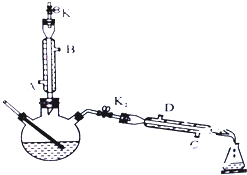 如图所示为制取乙酸乙酯的实验装置改进图,请回答下列问题
如图所示为制取乙酸乙酯的实验装置改进图,请回答下列问题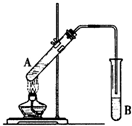 在试管A中加入3mL乙醇,然后边振荡管边慢慢加入2mL浓硫酸和2mL乙酸,按如图所示连接好装置进行实验,以制取乙酸乙酯.
在试管A中加入3mL乙醇,然后边振荡管边慢慢加入2mL浓硫酸和2mL乙酸,按如图所示连接好装置进行实验,以制取乙酸乙酯.