题目内容
18.实验室用乙醇和必要的无机试剂制取1,2-二溴乙烷的装置如图,1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.请回答以下问题: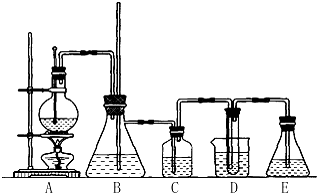
(1)装置A的烧瓶中装入乙醇和浓硫酸的混合液后还需加入碎瓷片(或沸石).烧瓶内发生的反应的化学方程式为C2H5OH$→_{△}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O.
(2)装置B的作用是防止倒吸或用作安全瓶 .
(3)装置C中盛有10%的NaOH溶液,其作用是洗去乙烯中混有的少量SO2、CO2.
(4)装置D中试管中装有液溴,实验开始后观察到的主要现象是液体颜色变浅.
(5)开始反应时需向装置D中的烧杯里加入冰水,这是为了降温,防止液溴挥发.
(6)装置E的作用尾气处理,吸收多余的Br2防止污染环境.
分析 制取1,2-二溴乙烷,由实验装置可知,A中乙醇发生消去反应生成乙烯,加碎瓷片可防止暴沸,可能发生C与浓硫酸的副反应生成SO2、CO2,B中短导管进入可防止倒吸,C中NaOH溶液可除杂乙烯中混有的杂质,D中溴与乙烯发生加成反应生成1,2-二溴乙烷,溴易挥发,则D中冰水冷却防止溴挥发,最后尾气处理装置E中NaOH溶液可吸收溴,以此来解答.
解答 解:(1)装置A的烧瓶中装入乙醇和浓硫酸的混合液后还需加入碎瓷片(或沸石),可防止暴沸,烧瓶内发生的反应的化学方程式为C2H5OH$→_{△}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,故答案为:碎瓷片(或沸石);C2H5OH$→_{△}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O;
(2)装置B的作用是防止倒吸或用作安全瓶,故答案为:防止倒吸或用作安全瓶;
(3)A中可能发生副反应生成SO2、CO2,则装置C中盛有10%的NaOH溶液,其作用是洗去乙烯中混有的少量SO2、CO2,
故答案为:洗去乙烯中混有的少量SO2、CO2;
(4)D中乙烯与溴发生加成反应,则装置D中试管中装有液溴,实验开始后观察到的主要现象是液体颜色变浅,
故答案为:液体颜色变浅;
(5)溴易挥发,开始反应时需向装置D中的烧杯里加入冰水,这是为了降温,防止液溴挥发,
故答案为:降温,防止液溴挥发;
(6)溴有毒,可污染环境,则装置E的作用为尾气处理,吸收多余的Br2防止污染环境,故答案为:尾气处理,吸收多余的Br2防止污染环境.
点评 本题考查有机物的制备实验,为高频考点,把握有机物的性质、制备原理、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验技能及环境保护,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列各离子或分子组能在水溶液中大量共存的是( )
| A. | NH4+、Cl2、NO3-、Fe2+ | B. | Fe3+、ClO-、Na+、SO32- | ||
| C. | CO32-、S2-、Na+、Ba2+ | D. | SO42-、Cl-、Na+、Al3+ |
3.甲 乙两烧杯各盛有200ml 3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后侧的生成的气体体积比为$\frac{{V}_{甲}}{{V}_{乙}}$=$\frac{3}{4}$则加入铝粉的质量为( )
| A. | 7.2g | B. | 5.4g | C. | 3.6g | D. | 2.7g |
10.必须加入氧化剂才能实现的变化是( )
| A. | MnO4-→Mn2+ | B. | NaOH→NaCl | C. | KClO3→O2 | D. | CO→CO2 |
7. 已知X为一种常见酸的浓溶液,能使蔗糖变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
已知X为一种常见酸的浓溶液,能使蔗糖变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
 已知X为一种常见酸的浓溶液,能使蔗糖变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
已知X为一种常见酸的浓溶液,能使蔗糖变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )| A. | 若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到白色沉淀产生 | |
| B. | 若A为铁,则足量A与X在室温下即可完全反应 | |
| C. | X使蔗糖变黑的现象主要体现了X的脱水性 | |
| D. | 工业上,B转化为D的反应条件为高温、常压、使用催化剂 |
8.X、Y是元素周期表ⅦA族中的两种元素,X的非金属性比Y强.则下列叙述中正确的是( )
| A. | X原子的电子层数比Y原子的电子层数多 | |
| B. | Y的单质能将X从NaX的溶液中置换出来 | |
| C. | X的单质比Y的单质更容易与氢气反应 | |
| D. | X的氢化物水溶液的酸性一定比Y的氢化物水溶液的酸性强 |