题目内容
8.(1)现有CH4、C2H2、C2H4、C2H6、C3H6五种有机物,质量相同时,五种物质完全燃烧生成的CO2最多的是C2H2,C6H6.(2)由乙炔(C2H2)、苯、乙醛(C2H4O)组成的混合物,经测定其中碳的质量分数为72%,则氧的质量分数为19.6%(保留一位小数).
分析 (1)分子中含碳量越高,在质量相等时生成的CO2越多,据此分析;
(2)乙醛(C2H4O)可以表示为C2H2.H2O,故乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体可以看做C6H6、C2H2、H2O的混合物,进一步看作CH与H2O的混合物,先利用C的质量分数来计算CH的质量分数,然后得到H2O的质量分数,再根据水的化学式O元素质量分数.
解答 解:(1)分子中含碳量越高,在质量相等时生成的CO2越多,所以CH4、C2H2、C2H4、C2H6、C3H6五种有机物生成CO2最多的是C2H2,C6H6,
故答案为:C2H2,C6H6;
(2)乙醛(C2H4O)可以表示为C2H2.H2O,故乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体可以看做C6H6、C2H2、H2O的混合物,C6H6、C2H2的最简式为CH,进一步看作CH与H2O的混合物,C元素的质量分数为72%,则CH的质量分数为72%÷$\frac{12}{13}$=78%,故H2O的质量分数为1-78%=22%,故O元素质量分数=22%×$\frac{16}{18}$=19.6%;
故答案为:19.6%.
点评 本题考查了有机物燃烧的有关计算、混合物中元素质量分数的计算,题目难度中等,(2)中解题的关键是根据乙醛的化学式将物质转化为最简式为CH与水的混合物.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
1.下列表示物质结构的化学用语正确的是( )
| A. | 8个中子的碳原子的核素符号:12C | B. | 氮气的电子式: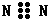 | ||
| C. | Cl-离子的结构示意图: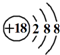 | D. | NaCl的电子式: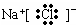 |
19.某稀溶液中含有HCO3-、SO32-、CO32-、CH3COO-、NH4+、Na+等多种阴、阳离子.若向其中加入适量的Na2O2固体后,你认为原溶液中离子浓度基本保持不变的微粒有( )
| A. | 3种 | B. | 2种 | C. | 1种 | D. | 无,都有变化 |
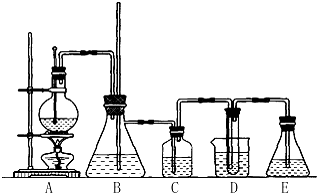
3.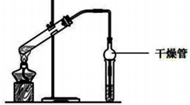 (1)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业实验室用如图的装置制备乙酸乙酯.
(1)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业实验室用如图的装置制备乙酸乙酯.
①与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是防止发生倒吸.
②己知表格数据:
③根据表数据分析,为什么乙醇需要过量一些,其原因是乙醇的沸点低,易挥发而损耗.
(2)按正确操作重新实验,该学生很快在小试管中收集到了乙_酸乙酯、乙酸、乙醇的混合物.现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,图是分离操作步骤流程图.在图中圆括号表示加入适当的试剂,编号表示适当的分离方法.
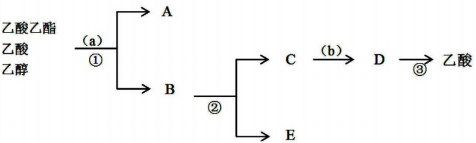
①写出加入的试剂名称:试剂(a)是饱和碳酸钠溶液;试剂(b)是稀硫酸溶液.
②写出有关的操作分离方法:①是分液,②是蒸馏,③是蒸馏.
 (1)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业实验室用如图的装置制备乙酸乙酯.
(1)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业实验室用如图的装置制备乙酸乙酯.①与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是防止发生倒吸.
②己知表格数据:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) |
| 乙醇 | -144 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | -- | 338 | 1.84 |
(2)按正确操作重新实验,该学生很快在小试管中收集到了乙_酸乙酯、乙酸、乙醇的混合物.现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,图是分离操作步骤流程图.在图中圆括号表示加入适当的试剂,编号表示适当的分离方法.

①写出加入的试剂名称:试剂(a)是饱和碳酸钠溶液;试剂(b)是稀硫酸溶液.
②写出有关的操作分离方法:①是分液,②是蒸馏,③是蒸馏.
13.胶体在人们的日常生活中随处可见.下列分散系属于胶体的是( )
| A. | 泥水 | B. | 豆浆 | C. | 生理盐水 | D. | 油水双合物 |
17.下列说法中,正确的是( )
| A. | 在光照条件下,体积比为1:1的CH4和Cl2充分反应可以制取CH3Cl | |
| B. | 乙烯和苯都可与溴水发生加成反应 | |
| C. | 用新制氢氧化铜可以检验淀粉是否完全水解 | |
| D. | 分子式同为C3H7Cl,但沸点不同的分子共有两种 |