题目内容
10.必须加入氧化剂才能实现的变化是( )| A. | MnO4-→Mn2+ | B. | NaOH→NaCl | C. | KClO3→O2 | D. | CO→CO2 |
分析 必须加入氧化剂才能实现,则选项中为还原剂发生的氧化反应,还原剂中某元素的化合价升高,以此来解答.
解答 解:A.MnO4-→Mn2+中Mn元素的化合价降低被还原,需要加入还原剂,故A错误;
B.NaOH→NaCl中没有元素的化合价变化,不需要加氧化剂,故B错误;
C.KClO3→O2通过加热可以实现,不需要加入氧化剂,故C错误;
D.CO→CO2中C元素的化合价升高,需要加氧化剂实现,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力考查,注意从元素化合价角度分析,题目难度不大.

练习册系列答案
相关题目
1.下列仪器名称书写规范的是( )
| A. | 研钵 | B. | 溶量瓶 | C. | 三角架 | D. | 瓷坩锅 |
5.下列离方程式书写正确的是( )
| A. | 锌锰干电池电极总反应为:Zn+2MnO2+2NH4Cl=Mn2O3+ZnCl2+2NH3+H2O,则正极反应为:2MnO2+2H++2e-=Mn2O3+H2O | |
| B. | 将1mol过氧化钠投入含有1molAlCl3的溶液中:6Na2O2+6H2O+4Al3+=4Al(OH)3↓+3O2↑+12Na+ | |
| C. | NaHSO4溶液中加入Ba(OH)2溶液至溶液呈中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 将16.8g 铁粉投入100mL 4.0mol/L的HNO3溶液中(还原产物只有NO)6Fe+20 H++5NO3-=3Fe2++3Fe3++5NO↑+10H2O |
15.a、b、c、d为原子序数依次增大的短周期主族元素,a的最外层电子数为其质子数的一半,b的最外层只有1个电子,c的最高化合价与最低化合价的代数和为4.下列叙述正确的是( )
| A. | a是一种非金属元素 | |
| B. | b与氧元素组成的氧化物一定是碱性氧化物 | |
| C. | c和d形成的化合物c2d2中各原子的最外层均达到8电子稳定结构 | |
| D. | b、c、d与氢元素形成的化合物中化学键均为极性共价键 |
2.能正确表示下列反应的离子方程式的是( )
| A. | 石灰石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | Na2C03溶液显碱性:C032-+H2O═HCO3-+OH- | |
| C. | 过量铁屑溶于稀硝酸:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| D. | FeI2溶液中通入少量氯气:2Fe2++C12═2Fe3++2Cl- |
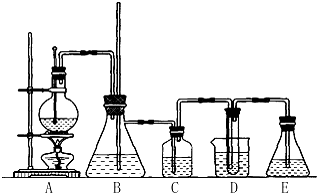
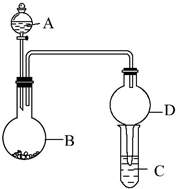 用如图所示装置进行实验(夹持装置已略去).请回答下列问题:
用如图所示装置进行实验(夹持装置已略去).请回答下列问题: