题目内容
下列离子方程式中,书写正确的是( )
| A、硅酸和氢氧化钾溶液反应:H2SiO3+2OH-=SiO32-+2H2O |
| B、硅和浓氢氧化钠溶液反应:Si+2OH-+H2O=SiO32-+2H2↑ |
| C、碳酸氢钙溶液跟稀盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+CO2↑ |
| D、饱和碳酸钠溶液中通入过量的CO2:CO32-+H2O+CO2=2HCO3- |
考点:离子方程式的书写
专题:
分析:A.硅酸为弱酸,硅酸与氢氧化钾反应生成硅酸根离子和水;
B.单质硅与氢氧化钠反应生成硅酸钠和氢气,根据电荷守恒、质量守恒定律判断;
C.碳酸氢钙为易溶物,离子方程式中需要拆开,不能保留化学式;
D.碳酸氢钠的溶解度小于碳酸钠,饱和碳酸钠溶液中通入过量的CO2,反应生成碳酸氢钠沉淀.
B.单质硅与氢氧化钠反应生成硅酸钠和氢气,根据电荷守恒、质量守恒定律判断;
C.碳酸氢钙为易溶物,离子方程式中需要拆开,不能保留化学式;
D.碳酸氢钠的溶解度小于碳酸钠,饱和碳酸钠溶液中通入过量的CO2,反应生成碳酸氢钠沉淀.
解答:
解:A.硅酸和氢氧化钾溶液反应生成硅酸钾和水,反应的离子方程式为:H2SiO3+2OH-=SiO32-+2H2O,故A正确;
B.硅和浓氢氧化钠溶液反应生成硅酸钠和氢气,反应的离子方程式为:Si+2OH-+H2O=SiO32-+2H2↑,故B正确;
C.碳酸氢钙溶液跟稀盐酸反应,碳酸氢钙需要拆开,正确的离子方程式为:HCO3-++H+=H2O+CO2↑,故C错误;
D.向饱和碳酸钠溶液中通入足量二氧化碳气体,生成碳酸氢钠沉淀,正确的离子方程式:2Na++CO32-+H2O+CO2=2NaHCO3↓,故D错误;
故选AB.
B.硅和浓氢氧化钠溶液反应生成硅酸钠和氢气,反应的离子方程式为:Si+2OH-+H2O=SiO32-+2H2↑,故B正确;
C.碳酸氢钙溶液跟稀盐酸反应,碳酸氢钙需要拆开,正确的离子方程式为:HCO3-++H+=H2O+CO2↑,故C错误;
D.向饱和碳酸钠溶液中通入足量二氧化碳气体,生成碳酸氢钠沉淀,正确的离子方程式:2Na++CO32-+H2O+CO2=2NaHCO3↓,故D错误;
故选AB.
点评:本题考查了离子方程式的书写判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
下列方法不能用于进行金属防腐处理的是( )
| A、油漆 | B、铝热反应 |
| C、电镀 | D、改变金属内部结构 |
由14CO和12CO组成的混合气体与同温同压下空气的密度相等(空气的平均相对分子质量为29,)则下列关系正确的是( )
| A、混合气体中,12CO占有的体积大于14CO占有的体积 |
| B、混合气体中,12CO与14CO分子个数比为1:2 |
| C、混合气体中,12CO与14CO质量比为15:14 |
| D、混合气体中,12CO与14CO密度比为14:15 |
下列电离方程式正确的是( )
| A、CaCl2=Ca2++Cl2- |
| B、Ba(OH)2=Ba+2+2(OH)- |
| C、HNO3=H++NO3- |
| D、KClO3=K++Cl-+3O2- |
X、Y、Z三种元素位于周期表中同一周期,它们的最高价氧化物分别为酸性氧化物、碱性氧化物、两性氧化物,则下列说法正确的是( )
| A、原子半径:X>Y>Z |
| B、最高正价:Y>Z>X |
| C、原子序数:X>Z>Y |
| D、金属性:Z>X>Y |
下列各组均为两种化合物溶于水时电离出的离子,其中由酸电离产生的是( )
| A、Na+、OH-、SO42- |
| B、H+、SO42-、Cl- |
| C、Na+、K+、OH- |
| D、K+、Na+、Cl- |
在2L的密闭容器中把4molA和2molB混合,在一定条件下发生反应3A(g)+2B(g)?zC(g)+2D(g).2min后反应达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol/(L?min).则下列说法不正确的是( )
| A、z=4 | ||
| B、B的转化率是40% | ||
| C、A的平衡浓度是1.4mol/L | ||
D、平衡时气体压强是原来的
|
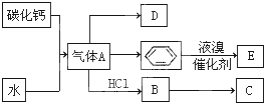 C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,它可以催熟果实.根据以下化学反应框图填空:
C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,它可以催熟果实.根据以下化学反应框图填空: