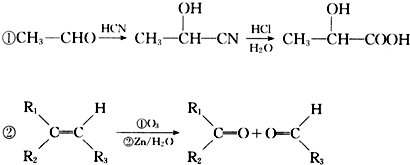
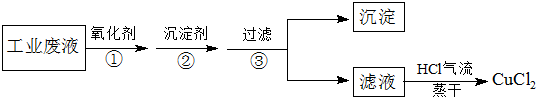
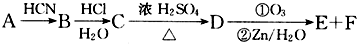题目内容
下列各组均为两种化合物溶于水时电离出的离子,其中由酸电离产生的是( )
| A、Na+、OH-、SO42- |
| B、H+、SO42-、Cl- |
| C、Na+、K+、OH- |
| D、K+、Na+、Cl- |
考点:电解质在水溶液中的电离
专题:
分析:酸是物质溶于水电离成的阳离子全部为H+,则在酸的溶液中不会存在金属阳离子,据此判断.
解答:
解:A、Na+不可能是酸电离产生的,酸电离产生的阳离子应全部为H+,故A错误;
B、因阳离子全部为H+,可理解为盐酸和硫酸两种物质溶于水时电离出的离子,故B正确;
C、Na+、K+不可能是酸电离产生的,因阴离子只有OH-,应为两种碱,故C错误;
D、Na+、K+、Cl-溶液中无H+,不会是酸电离产生的,因有金属离子和氯离子,则为盐电离产生的离子,故D错误;
故选B.
B、因阳离子全部为H+,可理解为盐酸和硫酸两种物质溶于水时电离出的离子,故B正确;
C、Na+、K+不可能是酸电离产生的,因阴离子只有OH-,应为两种碱,故C错误;
D、Na+、K+、Cl-溶液中无H+,不会是酸电离产生的,因有金属离子和氯离子,则为盐电离产生的离子,故D错误;
故选B.
点评:本题考查了概念的理解和判断,能够从离子的角度来认识酸、碱、盐的概念和构成,并熟悉常见的酸、碱、盐.

练习册系列答案
相关题目
下列离子方程式中,书写正确的是( )
| A、硅酸和氢氧化钾溶液反应:H2SiO3+2OH-=SiO32-+2H2O |
| B、硅和浓氢氧化钠溶液反应:Si+2OH-+H2O=SiO32-+2H2↑ |
| C、碳酸氢钙溶液跟稀盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+CO2↑ |
| D、饱和碳酸钠溶液中通入过量的CO2:CO32-+H2O+CO2=2HCO3- |
当温度达到374℃,压强为2.2×104KPa时,水处于超临界状态,此时水具有较高浓度的H+和OH-,能溶解更多的有机物质,下列对临界状态水的推测正确的是( )
| A、超临界水的pH较常温时升高 |
| B、超临界水的离子积增大 |
| C、超临界水发生了化学变化 |
| D、大多数有机物在超临界水中溶解度更小 |
下列关于酸、碱、盐、氧化物的元素组成的说法中,正确的是( )
| A、酸、碱一定含有氢,盐一定不含氢 |
| B、碱、盐可能含氧,酸一定含氧 |
| C、酸、碱、盐可能都不含金属元素 |
| D、金属氧化物一定是碱性氧化物 |
进行中和滴定时,事先不应该用所盛溶液润洗的仪器是(已用蒸馏水洗过)( )
| A、酸式滴定管 | B、碱式滴定管 |
| C、锥形瓶 | D、量筒 |