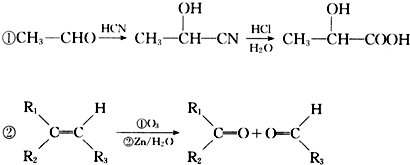
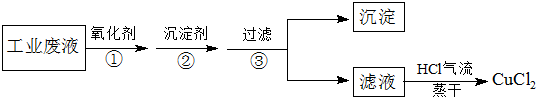
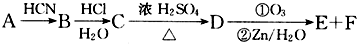题目内容
由14CO和12CO组成的混合气体与同温同压下空气的密度相等(空气的平均相对分子质量为29,)则下列关系正确的是( )
| A、混合气体中,12CO占有的体积大于14CO占有的体积 |
| B、混合气体中,12CO与14CO分子个数比为1:2 |
| C、混合气体中,12CO与14CO质量比为15:14 |
| D、混合气体中,12CO与14CO密度比为14:15 |
考点:阿伏加德罗定律及推论
专题:阿伏加德罗常数和阿伏加德罗定律
分析:同温同压下,气体摩尔体积相等,根据ρ=
知,其密度之比等于其摩尔质量之比,二者密度相等,则其摩尔质量相等,14CO和12CO的摩尔质量分别是30、28,假设14CO的物质的量为xmol、12CO的物质的量为ymol,其平均摩尔质量=
mol/L=29g/mol,x:y=1:1,
A.根据V=nVm知,其体积之比等于其物质的量之比;
B.根据N=nNA知,其分子数之比等于其物质的量之比;
C.根据m=nM知,相同物质的量时其质量之比等于摩尔质量之比;
D.根据ρ=
知,其密度之比等于摩尔质量之比.
| M |
| Vm |
| 30x+28y |
| x+y |
A.根据V=nVm知,其体积之比等于其物质的量之比;
B.根据N=nNA知,其分子数之比等于其物质的量之比;
C.根据m=nM知,相同物质的量时其质量之比等于摩尔质量之比;
D.根据ρ=
| M |
| Vm |
解答:
解:同温同压下,气体摩尔体积相等,根据ρ=
知,其密度之比等于其摩尔质量之比,二者密度相等,则其摩尔质量相等,14CO和12CO的摩尔质量分别是30、28,假设14CO的物质的量为xmol、12CO的物质的量为ymol,其平均摩尔质量=
mol/L=29g/mol,x:y=1:1,
A.根据V=nVm知,其体积之比等于其物质的量之比,14CO和12CO的物质的量相等,所以其体积相等,故A错误;
B.根据N=nNA知,其分子数之比等于其物质的量之比,14CO和12CO的物质的量相等,所以其分子数相等,故B错误;
C.根据m=nM知,相同物质的量时其质量之比等于摩尔质量之比,12CO与14CO的物质的量相等,所以其质量之比=28g/mol:30g/mol=14:15,故C错误;
D.根据ρ=
知,其密度之比等于摩尔质量之比,12CO与14CO的密度之比=28g/mol:30g/mol=14:15,故D正确;
故选D.
| M |
| Vm |
| 30x+28y |
| x+y |
A.根据V=nVm知,其体积之比等于其物质的量之比,14CO和12CO的物质的量相等,所以其体积相等,故A错误;
B.根据N=nNA知,其分子数之比等于其物质的量之比,14CO和12CO的物质的量相等,所以其分子数相等,故B错误;
C.根据m=nM知,相同物质的量时其质量之比等于摩尔质量之比,12CO与14CO的物质的量相等,所以其质量之比=28g/mol:30g/mol=14:15,故C错误;
D.根据ρ=
| M |
| Vm |
故选D.
点评:本题考查阿伏伽德罗定律及其推论,明确物质的量公式中各个物理量的关系是解本题关键,熟练掌握物质的量有关公式并灵活运用,题目难度不大.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
在由硫酸钾、硫酸铁和硫酸组成的混合溶液中,C(H+)=0.1mol/L,C(Fe3+)=0.3mol/L,C(SO42-)=0.6mol/L,则C(K+)为( )
| A、0.1mol/L |
| B、0.2mol/L |
| C、0.3mol/L |
| D、0.4mol/L |
在一定温度和压强下,将装有N2和NO2混合气体的试管倒立于水槽中,最后试管内气体的体积缩小为原体积的
,则混合气体中N2与NO2的体积比是( )
| 3 |
| 5 |
| A、2:3 | B、3:2 |
| C、3:5 | D、5:3 |
决定物质体积大小的主要因素,其中不包括( )
| A、微粒间引力 |
| B、微粒的数目 |
| C、微粒的大小 |
| D、微粒间平均距离 |
下列离子方程式中,书写正确的是( )
| A、硅酸和氢氧化钾溶液反应:H2SiO3+2OH-=SiO32-+2H2O |
| B、硅和浓氢氧化钠溶液反应:Si+2OH-+H2O=SiO32-+2H2↑ |
| C、碳酸氢钙溶液跟稀盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+CO2↑ |
| D、饱和碳酸钠溶液中通入过量的CO2:CO32-+H2O+CO2=2HCO3- |