题目内容
13.碳酸钠和碳酸氢钠是生活中常见的盐,下列说法错误的是( )| A. | 可通入过量的CO2气体来除去NaHCO3溶液中少量的Na2CO3杂质 | |
| B. | 可采用滴加少量的澄清石灰水来鉴别Na2CO3和NaHCO3两种白色固体 | |
| C. | 等质量的Na2CO3和NaHCO3分别与足量的盐酸反应,后者放出的CO2多 | |
| D. | 通过称取ag Na2CO3和NaHCO3的混合物经充分加热冷却后恒重bg能够测出混合物中Na2CO3的质量分数 |
分析 A.碳酸钠和二氧化碳、水反应生成碳酸钠,把杂质转化为NaHCO3溶液的溶质;
B.都能澄清石灰水反应生成碳酸钙沉淀;
C.利用n=$\frac{m}{M}$,可计算物质的量,因酸足量,利用Na2CO3~CO2,NaHCO3~CO2来分析;
D.能确定碳酸钠、碳酸氢钠任一物质的质量,即可测定混合物中NaHCO3质量分数,碳酸氢钠的不稳定性,加热分解,利用固体差量法即可计算出固体中碳酸氢钠的质量;
解答 解:A.碳酸钠和二氧化碳、水反应生成碳酸钠,可通入过量的CO2气体来除去NaHCO3溶液中少量的Na2CO3杂质,故A正确;
B.Na2CO3和NaHCO3均可与澄清石灰水反应产生白色沉淀,现象相同,无法鉴别,故B错误;
C.设质量都是106g,则Na2CO3和NaHCO3的物质的量分别为1mol、$\frac{106}{84}$mol,根据Na2CO3~CO2,NaHCO3~CO2,产生的CO2的物质的量分别为1mol、$\frac{106}{84}$mol,故C正确.
D.NaHCO3受热易分解生成碳酸钠、水和二氧化碳,所以通过加热分解利用差量法即可计算出Na2CO3质量分数,故D正确;
故选B.
点评 本题考查碳酸钠和碳酸氢钠的性质,涉及检验方法、稳定性、与酸的反应等,注意碳酸钠和碳酸氢钠和石灰水都反应生成沉淀,题目难度不大.

练习册系列答案
相关题目
1.下列晶体中由原子直接构成的单质有( )
| A. | 硫 | B. | 生铁 | C. | 金刚石 | D. | 金属镁 |
8.有机物分子中的原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列各项的事实不能说明上述观点的是( )
| A. | 苯酚与浓硝酸、浓硫酸反应生成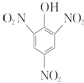 ,苯与浓硝酸、浓硫酸反应生成硝基苯 ,苯与浓硝酸、浓硫酸反应生成硝基苯 | |
| B. | 乙烯能发生加成反应,乙醇不能发生加成反应 | |
| C. | 苯酚能和氢氧化钠溶液反应,而乙醇不能和氢氧化钠溶液反应 | |
| D. | 苯酚苯环上的氢比苯分子中的氢更容易被卤素原子取代 |
5.某有机物的结构简式为CH2═CHCH2COOH,下列对其化学性质的判断中不正确的是( )
| A. | 能使紫色石蕊变红 | |
| B. | 能使KMnO4酸性溶液褪色 | |
| C. | 该有机物不能与NaOH发生反应 | |
| D. | 1mol该有机物只能与1mol Br2发生加成反应 |



