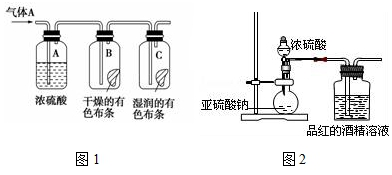
题目内容
4. 表中是不同温度下水的离子积的数据:
表中是不同温度下水的离子积的数据:| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
(1)若25<t1<t2,则a>(填“>”、“<”或“=”)1×10-14
(2)在t2温度下测得某溶液pH=7,该溶液显碱(填“酸”、“碱”或“中”)性.
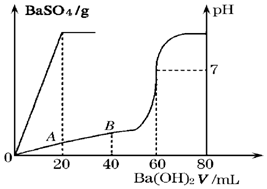
(3)25℃时,有盐酸和硫酸的混合液20mL,加入0.05mol•L-1的Ba(OH)2溶液时,生成BaSO4沉淀量及溶液的pH发生如图所示的变化.
则①原混合液中硫酸和盐酸的物质的量浓度分别是:c(H2SO4)=0.05 mol•L-1;c(HCl)=0.2 mol•L-1
②在A点时的pH=1 (设溶液混合后体积不变)
分析 (1)水是弱电解质,存在电离平衡,电离吸热;
(2)t2温度下水的离子积常数是1×10-12,cc(H+)<:c(OH-)显碱性;
(3)①根由图可知,0~20mLBa(OH)2溶液发生H2SO4+Ba(OH)2═BaSO4↓+H2O,20mL~60mLBa(OH)2溶液发生发生H++OH-═H2O,结合反应计算;
②根据A点溶液中氢离子浓度计算溶液的pH.
解答 解:(1)水是弱电解质,存在电离平衡,电离吸热.所以温度升高,水的电离程度增大,离子积增大,即a>1×10-14,
故答案为:>;
(2)t2温度下水的离子积常数是1×10-12,所以在该温度下,pH=6是显中性的.因此某溶液pH=7,该溶液显碱性,
故答案为:碱;
(3)①由图可知,0~20mLBa(OH)2溶液发生H2SO4+Ba(OH)2═BaSO4↓+H2O,20mL~60mLBa(OH)2溶液发生发生H++OH-═H2O,
设硫酸的物质的量为x,则
H2SO4+Ba(OH)2═BaSO4↓+H2O
1 1
x 0.02L×0.05mol•L-1
解得x=0.001mol,
硫酸的物质的量浓度为$\frac{0.001mol}{0.02L}$=0.05mol•L-1,
设HCl的物质的量为y,则
H++OH-═H2O
1 1
y 0.04L×2×0.05mol•L-1
解得y=0.004mol,
盐酸的物质的量浓度为$\frac{0.004mol}{0.02L}$=0.2mol/L,
故答案为:0.05;0.2;
②由图可知,A点硫酸完全反应,氢离子的浓度为$\frac{0.2mol/L×0.02L}{0.02L+0.02L}$=0.1mol/L,则pH=-lg0.1=1,故答案为:1.
点评 本题考查酸碱混合的计算,为高频考点,把握图象应用、发生的反应、pH计算等为解答的关键,侧重分析与计算能力的考查,注意数据及图象的分析,题目难度不大.

| 选项 | 实验事实 | 解释 |
| A | 加热蒸干MgSO4溶液能得到MgSO4固体;加热蒸干MgCl2溶液得不到MgCl2固体 | H2SO4不易挥发,HCl易挥发 |
| B | 电解CuCl2溶液,阴极得到Cu;电解NaCl溶液,阴极得不到Na | 得电子能力:Cu2+>Na+>H+ |
| C | 浓HNO3能氧化NO;稀HNO3不能氧化NO | HNO3浓度越大,氧化性越强 |
| D | 钠与乙醇反应平缓;钠与水反应剧烈 | 羟基中氢的活性:C2H5OH<H2O |
| A. | A | B. | B | C. | C | D. | D |

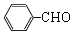 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2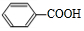 .
.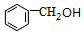 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$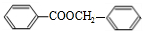 +H2O.
+H2O.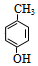 .
.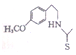 也能发生类似反应④的环化反应,VII的环化产物的结构简式
也能发生类似反应④的环化反应,VII的环化产物的结构简式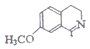 .
.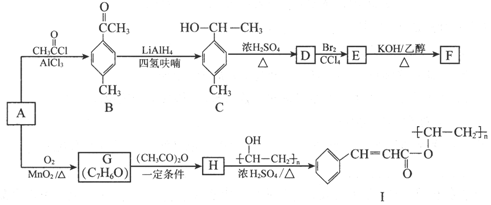
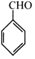
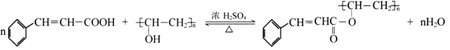
 (写出其中一种的结构简式).
(写出其中一种的结构简式). 的合成路线
的合成路线 .
.