题目内容
11.材料是人类生存和发展的重要物质基础,随着科学技术的发展,人们使用材料的种类、数量和质量也随着不断地发展,生产、生活的条件和质量也随之发生深刻的变化.请回答下列问题:(1)无机非金属材料包括传统无机非金属材料和新型无机非金属材料,下列属于新型无机非金属材料的是b、c、d、e(选字母代号).
a.复合材料 b.单晶硅 c.金刚石 d.石墨 e.碳-60f.玻璃
(2)撑杆跳项目中运动员使用的撑杆材料是复合材料.这种材料由基体和增强体两部分组成,其中增强体的作用是骨架作用.
(3)玻璃和水泥是两种用途极为广泛的材料.工业上制备这两种材料使用的共同原料是石灰石.
(4)铁是重要的金属材料,用铁矿石(主要成分是Fe2O3)冶炼铁是在炼铁高炉(填写工业生产设备名称)中完成的,这种方法冶炼出来的产品是生铁,该产品是炼钢的原料,炼钢的原理是在高温下用氧化剂除去生铁中的杂质,再添加其他硅、锰等元素调整其成分.
(5)合成高分子材料的小分子叫单体.某聚乙烯车间打算合成4.2×103kg的聚乙烯,则需要投料(乙烯)1.5×105mol.(假设反应过程不存在损失)
分析 (1)无机非金属材是以某些元素的氧化物、碳化物、氮化物、卤素化合物、硼化物以及硅酸盐、铝酸盐、磷酸盐、硼酸盐等物质组成的材料;
(2)复合材料是由基体和增强体构成,增强体起骨架作用;
(3)依据制备水泥、玻璃用到的原料解答;
(4)铁是重要的金属材料,用铁矿石(主要成分是Fe2O3)冶炼铁是在炼铁高炉中完成的,铁性质较不活泼用热还原法冶炼;
(5)合成高分子材料的小分子叫单体;乙烯聚合生成聚乙烯.
解答 解:(1)a.复合材料不是无机非金属材料,故不选;‘
b.单晶硅是新型无机非金属材料,故选;
c.金刚石是新型无机非金属材料,故选;
d.石墨是新型无机非金属材料,故选;
e.碳-60是新型无机非金属材料,故选;
f.玻璃是传统无机非金属材料,故不选;
故选:b、c、d、e;
(2)撑杆跳项目中运动员使用的撑杆材料是复合材料.这种材料由基体和增强体两部分组成,其中增强体的作用是骨架作用;
故答案为:基体 骨架作用;
(3)石灰石是制备玻璃、水泥等物质的工业原料之一,二者都用到石灰石;
故答案为:石灰石;
(4)铁是重要的金属材料,用铁矿石(主要成分是Fe2O3)冶炼铁是在炼铁高炉中完成的,原理为:在高温下用氧化剂除去生铁中的杂质,再添加其他硅、锰等元素调整其成分;
故答案为:炼铁高炉 在高温下用氧化剂除去生铁中的杂质,再添加其他硅、锰等元素调整其成分;
(5)合成高分子材料的小分子叫单体;聚乙烯车间打算合成4.2×103kg的聚乙烯,则需要投料(乙烯)物质的量为:$\frac{4.2×1{0}^{3}×1{0}^{3}g}{28g/mol}$=1.5×105(mol);
故答案为:单体; 1.5×105.
点评 本题为综合题,考查无机非金属材料、高炉炼铁、合成高分子材料,题目难度不大,掌握基础是解题关键.

| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75-85℃ | 易溶于水、有机溶剂 |
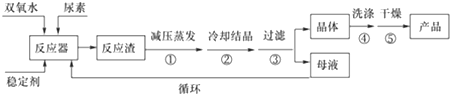
请回答下列问题:
(1)反应器的加热方式是水浴加热;反应温度需控制在适当温度下进行,温度不能过高的原因是温度过高,产品易分解,致使活性氧含量降低,温度也不能过低的原因温度过低,反应速率太慢,且反应体系制冷需要消耗大量能量.
(2)若欲从母液中分离出H2O2和尿素,可采用的操作是减压蒸馏、结晶.
(3)干法工艺制取过氧化尿素的方法是:采用高浓度双氧水水溶液喷雾到无水尿素固体上进行反应,水和反应热通过流态床移去而得到干燥的过氧化尿素产品.
比较干法与湿法两种工艺,你认为干法工艺的优点是:流程短,工艺简单 (答出一点即可),
干法工艺的缺点是:双氧水浓度高经济效益低,设备复杂;技术条件苛刻;产品稳定性差;产品污染不纯等 (答出两点即可),
湿法工艺的优点是:低浓度双氧水,经济效益高;设备简单易于达到;能耗低;产品稳定性好;母液可循环使用等 (答出两点即可).
(4)准确称取0.6000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加1mL 6mol•L-1 H2SO4,用0.1000mol•L-1 KMnO4标准溶液滴定至终点时消耗20.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2•H2O2的质量分数为78.3% (结果保留到小数点后一位).

| A. | 铅蓄电池的A极为正极,电极材料为PbO2 | |
| B. | 铅蓄电池放电时负极质量增加 | |
| C. | 该电解池的阴极反应为:2 NO3-+6H2O+10e-═N2↑+2OH- | |
| D. | 若电路中流过2mol电子,则阳极室溶液质量减少32g(忽略气体的溶液) |
 如图表示两项实验:①在燃着的蜡烛甲、乙上倒扣一只玻璃圆筒;②往放有燃着的蜡烛丙、丁的烧杯中慢慢倾入CO2气体.在两项实验中先熄灭的蜡烛分别是( )
如图表示两项实验:①在燃着的蜡烛甲、乙上倒扣一只玻璃圆筒;②往放有燃着的蜡烛丙、丁的烧杯中慢慢倾入CO2气体.在两项实验中先熄灭的蜡烛分别是( )| A. | 甲、丙 | B. | 乙、丙 | C. | 甲、丁 | D. | 乙、丁 |
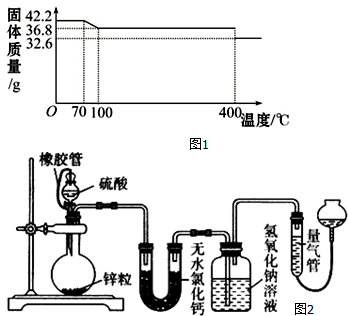
(1)试确定150℃时固体物质的化学式为K4[Fe(CN)6].
(2)在25℃下,将a mol•L-1的KCN(pH>7)溶液与0.01mol•L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a>0.01mol•L-1(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=(100a-1)×10-7 mol•L-1.
(3)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O═2H2SO4的转化.已知,含SO2的废气通入Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(4)不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图2装置进行实验(实验时压强为10lkPa,温度为0℃).
(Ⅰ)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中n(H2)=(cV-$\frac{m}{32}$)mol(用含字母的代数式表示).若撤走盛有无水氯化钙的U型管,n(SO2):n(H2)的数值将偏大(填偏大、偏小或无影响)
(Ⅱ)在硫酸中加入硫酸铜可以加快氢气的生成速率的原因:锌和铜构成原电池,加快反应速率
(Ⅲ)为进一步探究硫酸铜的量对氢气生成速率的影响,某同学设计如下一系列实验,将表中所给的混合溶液分别加入到5个盛有过量Zn粒的反应瓶中.
| 实验 溶液 | A | B | C | D | E |
| 5mol/LH2SO4 mL | 40 | V1 | V2 | V3 | V4 |
| 饱和CuSO4液 mL | 0 | 1 | 2 | V5 | 10 |
| H2O mL | V6 | V7 | V8 | 5 | 0 |
②为探究氢气生成速率要收集产生的气体,还需记录:收集等体积气体所需时间.
| A. | 51.2% | B. | 36.8% | C. | 41.5% | D. | 无法计算 |
| A. | 分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 | |
| B. | 杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 | |
| C. | H2SO4分子中三种原子均以杂化轨道成键 | |
| D. | N2分子中有一个σ键、2个π键 |
 .它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
.它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2K2SO4+FeSO4+3(NH4)2SO4+6CO↑