题目内容
在同温同压下,下列各组热化学方程式中,△H2>△H 1的是( )
| A、2H2(g)+O2(g)=2H2O(g),△H 1; 2H2(g)+O2(g)=2H2O(l),△H2 | ||||
| B、S(g)+O2(g)=SO2(g),△H1; S(s)+O2(g)=SO2(g),△H2 | ||||
C、C(s)+
| ||||
D、
|
考点:反应热的大小比较
专题:化学反应中的能量变化
分析:A、液态水变为气态水的过程是吸热过程;
B、固体硫变为气态硫需要吸收热量;
C、碳单质完全燃烧放热多于不完全燃烧放的热.
D、化学反应方程式的系数加倍,焓变数值加倍.
B、固体硫变为气态硫需要吸收热量;
C、碳单质完全燃烧放热多于不完全燃烧放的热.
D、化学反应方程式的系数加倍,焓变数值加倍.
解答:
解:A、物质的燃烧反应是放热的,焓变是负值,液态水变为气态水的过程是吸热的,故△H1>△H2,故A错误;
B、物质的燃烧反应是放热的,所以焓变是负值,固体硫变为气态硫需要吸收热量,所以△H1<△H2,故B正确;
C、碳单质完全燃烧生成二氧化碳放热多于不完全燃烧生成一氧化碳放的热,反应的焓变是负值,故△H1>△H2,故C错误;
D、化学反应方程式的系数加倍,焓变数值加倍,该化合反应是放热的,所以焓变值是负值,△H2=2△H1,△H1>△H2,故D错误;
故选:B.
B、物质的燃烧反应是放热的,所以焓变是负值,固体硫变为气态硫需要吸收热量,所以△H1<△H2,故B正确;
C、碳单质完全燃烧生成二氧化碳放热多于不完全燃烧生成一氧化碳放的热,反应的焓变是负值,故△H1>△H2,故C错误;
D、化学反应方程式的系数加倍,焓变数值加倍,该化合反应是放热的,所以焓变值是负值,△H2=2△H1,△H1>△H2,故D错误;
故选:B.
点评:本题考查了物质反应能量变化分析判断,主要是盖斯定律的应用,物质量不同、状态不同、产物不同,反应的能量变化本题,题目较简单.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
将0.3mol KCl、0.2mol Cu(NO3)2、0.1mol AgNO3一起溶于水,配成100mL混合溶液,用惰性电极电解一段时间后,若在一极析出9.6g Cu,此时在另一极上产生的气体体积(标准状况)为( )
| A、2.24 L |
| B、3.92 L |
| C、3.36 L |
| D、2.8 L |
下列能用勒沙特列原理解释的是( )
①红棕色NO2加压后颜色先变深后变浅
②SO2催化氧化成SO3的反应,往往加入过量的空气
③Fe(SCN)3溶液中加入固体KSCN后颜色变深
④氯水宜保存在低温、避光条件下
⑤乙酸乙酯在碱性条件下水解比在酸性条件下水解更有利.
①红棕色NO2加压后颜色先变深后变浅
②SO2催化氧化成SO3的反应,往往加入过量的空气
③Fe(SCN)3溶液中加入固体KSCN后颜色变深
④氯水宜保存在低温、避光条件下
⑤乙酸乙酯在碱性条件下水解比在酸性条件下水解更有利.
| A、①②⑤ | B、②③④ |
| C、①②③⑤ | D、全部 |
下列变化中需要加入还原剂才能实现的是( )
| A、CaCO3→CO2 |
| B、H+→H2 |
| C、Fe2+→Fe3+ |
| D、SO42-→BaSO4 |
下列说法合理的是( )
| A、若X+和Y2-的核外电子层结构相同,则原子序数:X>Y |
| B、由水溶液的酸性:HCI>H2S,可推断出元素的非金属性:CI>S |
| C、邻羟基苯甲醛沸点高于对羟基苯甲醛是因为形成了分子内氢键 |
| D、H-F、H-O、H-N三种共价键的极性逐渐增强 |
科学家发现一种化学式为O4的氧分子.1mol O3和1mol O4具有相同的( )
| A、分子数 | B、原子数 |
| C、质子数 | D、电子数 |
标准状体下,用质量相同的4种气体吹气球,那种气体吹起的气球体积最大( )
| A、O2 |
| B、H2 |
| C、CH4 |
| D、CO2 |
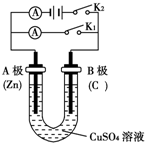 请按要求回答下列问题.
请按要求回答下列问题.