题目内容
高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子.制取高铁酸钠的化学方程式如下:
(1)□Fe(NO3)3+□NaOH+□Cl2═□Na2FeO4+□NaNO3+□NaCl+□H2O
(2)在上述反应中 (填元素名称)元素被氧化,当3mol Cl2参与反应时,转移电子的总数为 ;
(3)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,铁元素转化为Fe(OH)3胶体,使水中悬浮物聚沉,Fe(OH)3胶体微粒直径的范围是 .
(1)□Fe(NO3)3+□NaOH+□Cl2═□Na2FeO4+□NaNO3+□NaCl+□H2O
(2)在上述反应中
(3)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,铁元素转化为Fe(OH)3胶体,使水中悬浮物聚沉,Fe(OH)3胶体微粒直径的范围是
考点:氧化还原反应方程式的配平,氧化还原反应的电子转移数目计算,胶体的重要性质
专题:氧化还原反应专题,溶液和胶体专题
分析:(1)Fe元素的化合价由+3价升高到+6价,而Cl元素的化合价由0价降低到-1价,根据得失电子数目相等可知二者计量数之比为1:3,由于Cl2中Cl原子数为2,故Na2FeO4和NaCl的计量数分别为2和6;
在反应2Fe(NO3)3+16NaOH+3Cl2═2Na2FeO4+6NaNO3+6NaCl+8H2O中铁元素的价态由+3价升高到+6价,被氧化;
(2)在反应2Fe(NO3)3+16NaOH+3Cl2═2Na2FeO4+6NaNO3+6NaCl+8H2O中每消耗3molCl2,Cl原子得到6mol电子;
(3)胶体是分散质粒子大小介于1~100nm的分散系.
在反应2Fe(NO3)3+16NaOH+3Cl2═2Na2FeO4+6NaNO3+6NaCl+8H2O中铁元素的价态由+3价升高到+6价,被氧化;
(2)在反应2Fe(NO3)3+16NaOH+3Cl2═2Na2FeO4+6NaNO3+6NaCl+8H2O中每消耗3molCl2,Cl原子得到6mol电子;
(3)胶体是分散质粒子大小介于1~100nm的分散系.
解答:
解:(1)Fe元素的化合价由+3价升高到+6价,而Cl元素的化合价由0价降低到-1价,根据得失电子数目相等可知二者计量数之比为1:3,由于Cl2中Cl原子数为2,故Na2FeO4和NaCl的计量数分别为2和6,再根据原子守恒配平化学方程式为2Fe(NO3)3+16NaOH+3Cl2═2Na2FeO4+6NaNO3+6NaCl+8H2O;
故答案为:2Fe(NO3)3+16NaOH+3Cl2═2Na2FeO4+6NaNO3+6NaCl+8H2O;
(2)在反应2Fe(NO3)3+16NaOH+3Cl2═2Na2FeO4+6NaNO3+6NaCl+8H2O中铁元素的价态由+3价升高到+6价,被氧化;
在反应2Fe(NO3)3+16NaOH+3Cl2═2Na2FeO4+6NaNO3+6NaCl+8H2O中每消耗3molCl2,Cl原子得到6mol电子,故转移电子的总数为6NA;
故答案为:铁;6NA;
(3)胶体是分散质粒子大小介于1~100nm的分散系,所以Fe(OH)3胶体微粒直径的范围是1~100nm.
故答案为:1~100nm.
故答案为:2Fe(NO3)3+16NaOH+3Cl2═2Na2FeO4+6NaNO3+6NaCl+8H2O;
(2)在反应2Fe(NO3)3+16NaOH+3Cl2═2Na2FeO4+6NaNO3+6NaCl+8H2O中铁元素的价态由+3价升高到+6价,被氧化;
在反应2Fe(NO3)3+16NaOH+3Cl2═2Na2FeO4+6NaNO3+6NaCl+8H2O中每消耗3molCl2,Cl原子得到6mol电子,故转移电子的总数为6NA;
故答案为:铁;6NA;
(3)胶体是分散质粒子大小介于1~100nm的分散系,所以Fe(OH)3胶体微粒直径的范围是1~100nm.
故答案为:1~100nm.
点评:本题考查了氧化还原反应方程式的配平、氧化还原反应中电子转移数的计算以及胶体的概念问题,难度不大,注意基础知识的积累.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
用NA表示阿伏加徳罗常数的值,下列说法正确的是( )
| A、常温常压下,2.24L 氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1NA |
| B、30g乙酸和甲醛的混合物中氧原子数为NA |
| C、25℃时,2L0.1mol/L的Na2CO3溶液中含有的CO32-总数为0.2 NA |
| D、某密闭容器中盛有0.2molSO2和0.1molO2,在一定条件下充分反应,生成SO3分子数为0.2 NA |
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g)△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
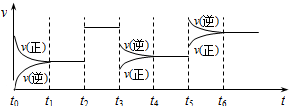

| A、t2时加入了催化剂(其它条件不变) |
| B、t3时降低了温度(其它条件不变) |
| C、t5时增大了压强(缩小容器体积,其它条件不变) |
| D、平衡状态时,t6时刻Z的百分含量最低 |
在同温同压下,下列各组热化学方程式中,△H2>△H 1的是( )
| A、2H2(g)+O2(g)=2H2O(g),△H 1; 2H2(g)+O2(g)=2H2O(l),△H2 | ||||
| B、S(g)+O2(g)=SO2(g),△H1; S(s)+O2(g)=SO2(g),△H2 | ||||
C、C(s)+
| ||||
D、
|
将5mol/L的AlCl3溶液a mL稀释至b mL,稀释后溶液中Cl-物质的量浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、1 molCl2与足量Fe反应转移电子数一定为3NA |
| B、标准状况下,2.24 L NH3中含有共价键的数目为NA |
| C、1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA |
| D、标况下,11.2 L CCl4所含的分子数目为0.5NA |
下列说法正确的是( )
| A、金属氧化物都能与水反应生成碱 |
| B、非金属氧化物都能与水反应生成酸 |
| C、氧化铝既能与酸反应又能与氨水反应 |
| D、氧化铝坩埚不能用于熔融烧碱 |