��Ŀ����
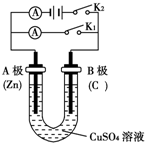 �밴Ҫ��ش��������⣮
�밴Ҫ��ش��������⣮��1������ͼ�ش�٢ڣ�
�ٴ�K2���պ�K1��A���缫��ӦʽΪ
�ڴ�K1���պ�K2��B���ɹ۲쵽��������
װ�÷������ܷ�Ӧ��ѧ����ʽ
��2���ı����缫�ĵ缫���ϣ����ø�װ��Ҫʵ�ַ�ӦCu+H2SO4�TCuSO4+H2��������Ӧ��
���㣺ԭ��غ͵��صĹ���ԭ��
ר�⣺�绯ѧר��
��������1�������Ͽ�K2���պ�K1���γ�ԭ��ط�Ӧ��ZnΪ��������������CuΪ������������ԭ��Ӧ����ͭ��
�����Ͽ�K1���պ�K2��Ϊ���أ�CΪ������ZnΪ�������ü�����������ͭ�����ݵ缫��Ӧ��д�ܷ�Ӧ�����ݵ����غ���м��㣻
��2��Ҫʵ�ַ�ӦCu+H2SO4�TCuSO4+H2�������������ͭ�������������ǵ���ʣ����������DZ�ͭ�����Բ�Ľ�����ǽ������ݴ˻ش�
�����Ͽ�K1���պ�K2��Ϊ���أ�CΪ������ZnΪ�������ü�����������ͭ�����ݵ缫��Ӧ��д�ܷ�Ӧ�����ݵ����غ���м��㣻
��2��Ҫʵ�ַ�ӦCu+H2SO4�TCuSO4+H2�������������ͭ�������������ǵ���ʣ����������DZ�ͭ�����Բ�Ľ�����ǽ������ݴ˻ش�
���
�⣺��1�������Ͽ�K2���պ�K1���γ�ԭ��ط�Ӧ��ZnΪ��������������п�����ܽ⣬Zn-2e-=Zn2+��CuΪ������������ԭ��Ӧ����ͭ���缫����ʽΪCu2++2e-�TCu���к�ɫ����������
�ʴ�Ϊ��Zn-2e-=Zn2+���к�ɫ����������
�����Ͽ�K1���պ�K2��Ϊ���أ�CΪ�����������缫��Ӧ��4OH--4e-=2H2O+O2����ZnΪ�������ü�����������ͭ������Cu2++2e-�TCu���ܷ�Ӧ�ǣ����2CuSO4+2H2O
2Cu+O2��+2H2SO4��ZnΪ��������Cu2++2e-�TCu��п�缫����ag��
molCu���ɣ�ת�Ƶ�����
mol�����������缫��Ӧ��4OH--4e-=2H2O+O2�������ɵ���������ǣ�
��
��22.4L/mol=0.175aL��
�ʴ�Ϊ��������ɫ��ζ�����壬4OH--4e-=2H2O+O2����2CuSO4+2H2O
2Cu+O2��+2H2SO4��0.175aL
��2��Ҫʵ�ַ�ӦCu+H2SO4�TCuSO4+H2�������������ͭʧ���ӣ����������������������ӵõ��ӵĻ�ԭ��Ӧ����2H++2e-=H2���������ǵ���ʣ����������DZ�ͭ�����Բ�Ľ�����ǽ�������ʱҪ�γɵ��أ�Ӧ��K1�պ�K2���ʴ�Ϊ��Ӧ��K1�պ�K2��H2SO4��Cu��2H++2e-=H2����
�ʴ�Ϊ��Zn-2e-=Zn2+���к�ɫ����������
�����Ͽ�K1���պ�K2��Ϊ���أ�CΪ�����������缫��Ӧ��4OH--4e-=2H2O+O2����ZnΪ�������ü�����������ͭ������Cu2++2e-�TCu���ܷ�Ӧ�ǣ����2CuSO4+2H2O
| ||
| a |
| 64 |
| a |
| 32 |
| a |
| 32 |
| 1 |
| 4 |
�ʴ�Ϊ��������ɫ��ζ�����壬4OH--4e-=2H2O+O2����2CuSO4+2H2O
| ||
��2��Ҫʵ�ַ�ӦCu+H2SO4�TCuSO4+H2�������������ͭʧ���ӣ����������������������ӵõ��ӵĻ�ԭ��Ӧ����2H++2e-=H2���������ǵ���ʣ����������DZ�ͭ�����Բ�Ľ�����ǽ�������ʱҪ�γɵ��أ�Ӧ��K1�պ�K2���ʴ�Ϊ��Ӧ��K1�պ�K2��H2SO4��Cu��2H++2e-=H2����
���������⿼����ԭ��غ͵���ԭ����֪��ԭ��غ͵�������֪�������缫�Ϸ����ĵ缫��Ӧ���ٽ�ϸ���������֮��Ĺ�ϵʽ���㣬��Ŀ�ѶȲ���

��ϰ��ϵ�д�
 ��Ӣ���㿨ϵ�д�
��Ӣ���㿨ϵ�д�
�����Ŀ
���л�ѧʵ�����ע�ⰲȫ������˵����ȷ���ǣ�������
| A��H2��ԭCuOʱ���ȼ���ʢCuO���Թܺ�ͨ��H2�������˷�H2 |
| B������ȼȼ����֮ǰ�����鴿 |
| C��ϡ��ŨH2SO4ʱ����ˮע��ʢŨH2SO4���ձ� |
| D�����Թ���Һ�����ʱ��Ϊ���ڹ۲죬�Թܿ�Ӧ�����Լ� |
�������Һ����������֮�������й��ڵ������Һ����������ȷ���ǣ�������
| A��Na2CO3��NaHCO3��������Һ�У����������ͬ | ||
| B�������£�1 mol?L-1��CH3COOH��Һ��1 mol?L-1��NaOH��Һ�������Ϻ����û��Һ�У�c��Na+����c��CH3COO-����c��H+����c��OH-�� | ||
| C�������£�ij��Һ����ˮ�������c��H+��=10-5mol?L-1�������Һ���������� | ||
D�����ʵ���Ũ����ͬ��NH4Cl��NH4HSO4������Һ�У�c��NH
|
����ˮ��Һ�д���������������ǣ�������
| A��K+ AlO2-Cl- OH- |
| B��H+ NH4+Fe2+ NO3- |
| C��Al3+ K+ Cl-AlO2- |
| D��H+ NH4+ CH3COO- Cl- |
��NA��ʾ�����ӏ�������ֵ������˵����ȷ���ǣ�������
| A�����³�ѹ�£�2.24L ���������������������Һ��ȫ��Ӧת�Ƶĵ�����Ϊ0.1NA |
| B��30g����ͼ�ȩ�Ļ��������ԭ����ΪNA |
| C��25��ʱ��2L0.1mol/L��Na2CO3��Һ�к��е�CO32-����Ϊ0.2 NA |
| D��ij�ܱ�������ʢ��0.2molSO2��0.1molO2����һ�������³�ַ�Ӧ������SO3������Ϊ0.2 NA |
����˵���У�������ǣ�������
| A����ѧ��Ӧ����ЧӦ�뷴Ӧ;���� |
| B����ѧ��Ӧ����ЧӦ�뷴Ӧ����ʼ״̬������״̬�й� |
| C��Ӧ�ø�˹���ɣ��ɼ���ijЩ����ֱ�Ӳ�����ЧӦ�ķ�Ӧ |
| D����˹����ֻ�����ڻ�ѧ��Ӧ�������仯�������������ʾۼ�״̬ת��ʱ�����仯 |
��ͬ��ͬѹ�£����и����Ȼ�ѧ����ʽ�У���H2����H 1���ǣ�������
| A��2H2��g��+O2��g��=2H2O��g������H 1�� 2H2��g��+O2��g��=2H2O��l������H2 | ||||
| B��S��g��+O2��g��=SO2��g������H1�� S��s��+O2��g��=SO2��g������H2 | ||||
C��C��s��+
| ||||
D��
|
 ���ϵIJ��Ϸ�չ���Դٽ���������
���ϵIJ��Ϸ�չ���Դٽ��������� �����м���Ԥ���������ĵĵ�������ʾ���ڱ����г����оų��ܼ���ˮ�����ɻ����ױƷ������°���ڱ�������������PAEs����ֵ��ע����ǣ��ڶ�ͯ�����ױƷ������������Ʒ�ֱ𱻼���ڱ��������������DEP�����ڱ����������2-�һ�����������DEHP����
�����м���Ԥ���������ĵĵ�������ʾ���ڱ����г����оų��ܼ���ˮ�����ɻ����ױƷ������°���ڱ�������������PAEs����ֵ��ע����ǣ��ڶ�ͯ�����ױƷ������������Ʒ�ֱ𱻼���ڱ��������������DEP�����ڱ����������2-�һ�����������DEHP����
