题目内容
相对分子质量为M的某物质在室温下的溶解度为S g,此时测得饱和溶液的密度ρg?cm-3,则该饱和溶液的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:物质的量浓度的相关计算
专题:
分析:根据饱和溶液的溶解度S可以计算出溶液中溶质的质量分数ω=
,然后根据溶质质量分数与物质的量浓度的关系c=
计算出该饱和溶液的物质的量浓度.
| S |
| 100+S |
| 1000ρw |
| M |
解答:
解:该饱和溶液中溶质的质量分数为:ω=
,该溶液的物质的量浓度为:c=
=
mol/L=
mol/L,
故选B.
| S |
| 100+S |
| 1000ρw |
| M |
1000ρ
| ||
| M |
| 1000Sρ |
| M(100+S) |
故选B.
点评:本题考查了物质的量浓度的计算,题目难度不大,注意掌握物质的量浓度与溶质质量分数的关系,明确物质的量浓度、溶质质量分数的表达式为解答本题的关键.

练习册系列答案
相关题目
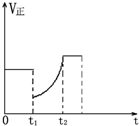 如图表示反应2SO2(g)+O2(g)═2SO3(g)△H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是( )
如图表示反应2SO2(g)+O2(g)═2SO3(g)△H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是( )| A、t1时减小了SO2 的浓度,增加了SO3的浓度,平衡向逆反应方向移动 |
| B、t1时降低了温度,平衡向正反应方向移动 |
| C、t1时减小了压强,平衡向逆反应方向移动 |
| D、t1时增加了SO2 和O2的浓度,平衡向正反应方向移动 |
下列说法不正确的是( )
| A、“白色污染”主要是由合成材料的废弃物,特别是一些塑料制品废弃物造成的 |
| B、“白色污染”只能影响环境卫生,没有其他危害 |
| C、治理“白色污染”主要应从减少使用、加强回收和再利用开始 |
| D、使用可降解塑料是治理“白色污染”的理想方法 |
下表为4种常见溶液中溶质的质量分数和物质的量浓度:这4种溶液中密度最小的是( )
| 溶 质 | HCl | NaOH | CH3COOH | HNO3 |
| 溶质的质量分数/% | 36.5 | 40 | 60 | 63 |
| 物质的量浓度/mol L-1 | 11.8 | 14.3 | 10.6 | 13.8 |
| A、HCl |
| B、NaOH |
| C、CH3COOH |
| D、NO3 |
下列关于 0.2mol/L 硝酸钾溶液的叙述中,正确的是( )
| A、1L 该溶液中含硝酸钾 202g |
| B、100mL 该溶液中含硝酸钾0.02mol |
| C、从 1L该溶液中取出500 mL 后,剩余溶液的浓度为0.1mol/L |
| D、1L水中溶解0.2mol硝酸钾,即可配得 0.2mol/L硝酸钾溶液 |
0.2molNa218O2与足量CO2完全反应后,所得固体质量为( )
| A、21.2g |
| B、21.6g |
| C、22.0g |
| D、22.4g |
假如12C相对原子质量为24,以0.024千克12C所含12C的原子数为阿伏加德罗常数.下列数值肯定不变的是( )
| A、阿伏加德罗常数 |
| B、摩尔质量 |
| C、一定质量气体的体积 |
| D、O2的相对分子质量 |
下列离子方程式书写正确的是( )
| A、过量二氧化碳通人偏铝酸钠溶液中:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32- | ||||
| B、氯化铝溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O | ||||
| C、在碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓ | ||||
D、碳酸氢铵溶液与过量的NaOH溶液混合:NH4++HCO3-+2OH-
|