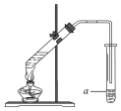
题目内容
3.关于如图所示的原电池,下列说法正确的是( )
| A. | 锌片发生还原反应 | |
| B. | 电子由锌片通过稀硫酸溶液流向铜片 | |
| C. | 铜片反应式为Cu2++2e-═Cu | |
| D. | 该电池发生的反应是Zn+2H +═Zn2++H2↑ |
分析 该原电池装置中,活泼金属锌易失电子作负极,铜作正极,负极上失电子发生氧化反应,正极上氢离子得电子发生还原反应生成氢气,电子从负极沿导线流向正极,自发进行的氧化还原反应为Zn+2H +═Zn2++H2↑.
解答 解:A.原电池装置中,活泼金属锌易失电子作负极发生氧化反应,电极反应为Zn-2e-=Zn2+,故A错误;
B.电子从负极沿导线流向正极,不能经过电解质溶液,故B错误;
C.铜为正极电极反应为;2H++2e-=H2↑,故C错误;
D.结合正负极电极反应得到电池反应为Zn+2H +═Zn2++H2↑,故D正确;
故选D.
点评 本题考查了原电池原理,根据电极上得失电子判断正负极,再结合电极反应类型、电子流向来分析解答,熟记原电池原理是解题的关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.硼是植物生长发育必需的微量元素之一,硼玻璃纤维用作火箭的防护材料.下列关于硼的叙述正确的是( )
| A. | 硼原子的L电子层中有2个电子 | B. | 硼酸是弱酸 | ||
| C. | 硼的金属性比铝的金属性强 | D. | 硼的原子半径比碳的原子半径小 |
11.下列元素中,属于第三周期IVA族的是( )
| A. | 钠 | B. | 氧 | C. | 硅 | D. | 硫 |
18.下列有关硅及其化合物的说法正确的是( )
| A. | 单质硅常用作半导体材料 | |
| B. | 硅在自然界中只以化合态的形式存在 | |
| C. | SiO2与纯碱高温生成CO2,说明硅酸的酸性比碳酸强 | |
| D. | SiO2是非金属氧化物,它不与任何酸反应 |
8.标准状况下,11.2L乙烯和乙烷的混合气体通入足量的溴水中,充分反应后,溴水的质量增加了5.6g.下列说法正确的是( )
| A. | 乙烯与乙烷是同分异构体 | |
| B. | 乙烯与乙烷都能使酸性高锰酸钾褪色 | |
| C. | 该混合气体中乙烯与跟乙烷的质量比为28:45 | |
| D. | 该混合气体中乙烯与乙烷的物质的量之比为3:2 |
15.放热的氧化还原反应能设计成原电池.下列反应中能设计成原电池的是( )
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 酸碱中和反应 | ||
| C. | 灼热的炭与CO2反应 | D. | H2与Cl2的燃烧反应 |
11.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol/L的Ca(C1O)2溶液中含C1O数目为2NA | |
| B. | 标准状况下,22.4L戊烷中的氢原子数约为12NA个 | |
| C. | 体积分别为1.0LpH=2的盐酸与硫酸溶液中氢离子数均为0.01NA | |
| D. | 1mol-OH与1molOH-所含电子数均为9NA |
14.${\;}_{10}^{20}$Ne是最早发现的Ne元素的稳定同位素,汤姆逊(J•J•Thomson)和阿斯通(F•W•Aston)在1913年发现了${\;}_{10}^{22}$Ne.下列有关说法正确的是( )
| A. | ${\;}_{10}^{22}$Ne和${\;}_{10}^{20}$Ne是同分异构体 | |
| B. | ${\;}_{10}^{22}$Ne和${\;}_{10}^{20}$Ne属于不同的核素 | |
| C. | ${\;}_{10}^{22}$Ne和${\;}_{10}^{20}$Ne的性质完全相同 | |
| D. | ${\;}_{10}^{22}$Ne转变为${\;}_{10}^{20}$Ne为化学变化 |

 .
.