题目内容
画出下列反应双线桥,指明电子转移情况,化合价升降和被氧化,被还原情况MnO2+4HCl浓
MnCl2+Cl2↑+2H2O
发生氧化反应, 是还原剂, 是氧化产物; 发生还原反应, 是氧化剂, 是还原产物.每生成1mol氯气,电子转移 mol,被氧化的HCl mol.
| ||
考点:氧化还原反应,氧化还原反应的计算
专题:氧化还原反应专题
分析:MnO2+4HCl浓
MnCl2+Cl2↑+2H2O中,Mn元素的化合价由+4价降低为+2价,Cl元素的化合价由-1价升高为0,该反应转移2e-,以此来解答.
| ||
解答:
解:在MnO2+4HCl浓
MnCl2+Cl2↑+2H2O的反应中,锰元素化合价降低,氯元素化合价升高,生成1molCl2转移电子数为2mol,由Cl原子守恒可知,被氧化的HCl为2mol,用“双线桥法”表示氧化还原反应中电子转移情况为: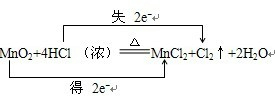 ,氯元素化合价升高,还原剂是HCl,发生氧化反应,氧化产物是Cl2;MnO2为氧化剂,发生还原反应,还原产物为;MnCl2,
,氯元素化合价升高,还原剂是HCl,发生氧化反应,氧化产物是Cl2;MnO2为氧化剂,发生还原反应,还原产物为;MnCl2,
故答案为: ;HCl;HCl;Cl2;MnO2;MnO2;MnCl2;2;2.
;HCl;HCl;Cl2;MnO2;MnO2;MnCl2;2;2.
| ||
 ,氯元素化合价升高,还原剂是HCl,发生氧化反应,氧化产物是Cl2;MnO2为氧化剂,发生还原反应,还原产物为;MnCl2,
,氯元素化合价升高,还原剂是HCl,发生氧化反应,氧化产物是Cl2;MnO2为氧化剂,发生还原反应,还原产物为;MnCl2,故答案为:
 ;HCl;HCl;Cl2;MnO2;MnO2;MnCl2;2;2.
;HCl;HCl;Cl2;MnO2;MnO2;MnCl2;2;2.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
在某无色透明的溶液中,能共存的离子组是( )
| A、Na+、H+、SO42-、HCO3- |
| B、MnO4-、Na+、S2-、K+ |
| C、Na+、K+、Cl-、NO3- |
| D、Fe3+、K+、SO42-、Cl- |
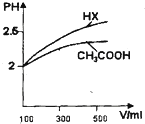 已知25℃时部分弱电解质的电离平衡常数数据如下表
已知25℃时部分弱电解质的电离平衡常数数据如下表 【物质结构与性质】
【物质结构与性质】