题目内容
12.有一结晶水合物x•6H2O,可发生如下的转化(部分反应物生成物已略).其中B、D、F均为无色气体,G为难于水的红褐色固体,在A溶液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀.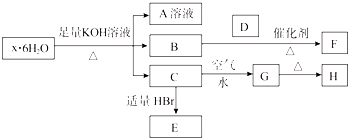
(1)该结晶水合物的化学式为(NH4)2Fe(SO4)2•6H2O.
(2)把C溶于过量的稀H2SO4,再加KMnO4溶液,所涉及的离子方程式:Fe(OH)2+2H+═Fe2++2H2O、5Fe2++8H++MnO4-═5Fe3++Mn2++4H2O.
(3)向E溶液中通入等物质的量的Cl2,写出反应的离子方程式:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-.
(4)C→G的现象为白色沉淀迅速变成灰绿色,最后变为红褐色,该反应的化学方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3.
(5)向一定量的Cu与H的混合物中加入300 mL 1 mol/L HCl溶液,恰好使混合物完全溶解,向所得溶液中加入KSCN溶液后无红色出现.若用过量的CO在高温下还原相同质量的此混合物,固体的质量减小2.4g.
分析 结晶水合物中加入KOH溶液生成气体B,则B一定为NH3,结晶水合物中含有NH4+,G为红褐色固体难溶物,说明其为Fe(OH)3,则C为Fe(OH)2,并说明结晶水合物中含Fe2+;A中加BaCl2溶液生成不溶于稀盐酸的白色沉淀,说明结晶水合物中含有SO42-,综上所述,结晶水合物为(NH4)2Fe(SO4)2•6H2O,则H为Fe2O3,E为FeBr2.
解答 解:结晶水合物中加入KOH溶液生成气体B,则B一定为NH3,结晶水合物中含有NH4+,G为红褐色固体难溶物,说明其为Fe(OH)3,则C为Fe(OH)2,并说明结晶水合物中含Fe2+;A中加BaCl2溶液生成不溶于稀盐酸的白色沉淀,说明结晶水合物中含有SO42-,综上所述,结晶水合物为(NH4)2Fe(SO4)2•6H2O,则H为Fe2O3,E为FeBr2.
(1)该结晶水合物的化学式为:(NH4)2Fe(SO4)2•6H2O,故答案为:(NH4)2Fe(SO4)2•6H2O;
(2)把Fe(OH)2溶于过量的稀H2SO4,再加KMnO4溶液,所涉及的离子方程式:Fe(OH)2+2H+═Fe2++2H2O、5Fe2++8H++MnO4-═5Fe3++Mn2++4H2O,
故答案为:Fe(OH)2+2H+═Fe2++2H2O、5Fe2++8H++MnO4-═5Fe3++Mn2++4H2O;
(3)Fe2+的还原性大于Br-,通入等物质的量Cl2,不足以将其全部氧化,先氧化Fe2+,再氧化Br-,反应的离子方程式:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-,
故答案为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-;
(4)Fe(OH)2变为Fe(OH)3的现象为白色沉淀迅速变成灰绿色,最后变为红褐色,该反应的化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:白色沉淀迅速变成灰绿色,最后变为红褐色;4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(5)H为Fe2O3,加入盐酸后发生反应依次为①Fe2O3+6HCl═2FeCl3+3H2O,②2FeCl3+Cu═CuCl2+2FeCl2.化合物恰好完全溶解,加入KSCN溶液后无红色出现,说明所得溶液溶质为CuCl2和FeCl2,原混合物中所含氧元素全部生成水,若用CO还原相同质量的混合物,其质量减少量为氧元素的质量,由题意,HCl的物质的量为0.3mol,结合方程式①,可得所含化合物中所含氧的物质的量等于生成水的物质的量,为0.15mol,其质量为0.15mol×16g/mol=2.4g,固体质量减少2.4g,
故答案为:2.4.
点评 本题考查无机物的框图推断、化学计算,关键是根据反应现象进行推断,熟练掌握元素化合物性质,(5)中注意根据反应判断化合物中所含氧的物质的量与HCl物质的量关系,难度中等.

| A. | Na+、Al3+、OH-、Br- | B. | H+、Fe2+、SO42-、CO32- | ||
| C. | K+、NH4+、CO32-、OH- | D. | Ca2+、Al3+、NO3-、Cl- |
| A. | 化学反应中既有物质变化又有能量变化 | |
| B. | 物质发生变化时,即使没有发生化学变化,也可能有能量的变化 | |
| C. | 任何化学反应中的能量变化都表现为放出热量或吸收热量 | |
| D. | 物质的化学能可以通过不同的变化方式转化为热能、电能等 |
| A. | NA个N2分子和NA个CO分子的质量之比为1:1 | |
| B. | 水的摩尔质量等于NA个水分子的相对分子质量之和 | |
| C. | 分别由NA个水分子组成的水、冰、水蒸气的质量各不相同 | |
| D. | 1 mol N2的质量等于NA个氮原子的质量 |
(1)海水中制得的氯化钠可用于生产烧碱及氯气.反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-.
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
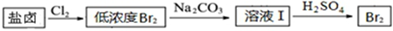
将Br2与Na2CO3反应的化学方程式补充完整:□Br2+□Na2CO3═NaBrO3+□5NaBr+□3CO2
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
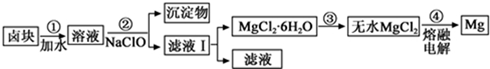
生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+.
③步骤③需在HCl保护气中加热进行,其原理涉及的离子方程式为Mg2++2H2O?Mg(OH)2+2H+.
④NaClO还能除去盐卤中的CO(NH2)2,生成盐类物质和能参与大气循环的物质.除去0.1mol CO(NH2)2时消耗NaClO22.35g.
| A. | 肯定有KNO3和Na2CO3,没有Ba(NO3)2 | |
| B. | 肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3 | |
| C. | 肯定没有Na2CO3和Ba(NO3)2,可能有KNO3 | |
| D. | 以上判断都不正确 |


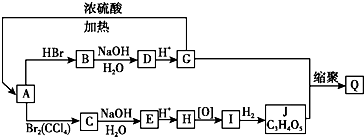
 在图所示物质的转化关系中,D在常温下为无色无味的液体(反应条件均已省略).请回答下列问题:
在图所示物质的转化关系中,D在常温下为无色无味的液体(反应条件均已省略).请回答下列问题: .
. .
.
 .
.