题目内容
在由硫酸钾、硫酸铁和硫酸组成的混合溶液中,C(H+)=0.1mol/L,C(Fe3+)=0.3mol/L,C(SO42-)=0.6mol/L,则C(K+)为( )
| A、0.1mol/L |
| B、0.2mol/L |
| C、0.3mol/L |
| D、0.4mol/L |
考点:物质的量浓度的相关计算
专题:
分析:溶液呈电中性,根据电荷守恒可知:c(K+)+c(H+)+3c(Fe3+)=2c(SO42-),据此计算c(K+).
解答:
解:溶液呈电中性,根据电荷守恒可知:c(K+)+c(H+)+3c(Fe3+)=2c(SO42-),
则:c(K+)+0.1mol/L+3×0.3mol/L=2×0.6mol/L,
解得c(K+)=0.2mol/L,
故选B.
则:c(K+)+0.1mol/L+3×0.3mol/L=2×0.6mol/L,
解得c(K+)=0.2mol/L,
故选B.
点评:本题考查物质的量浓度有关计算,难度不大,电解质混合溶液中常利用电荷守恒计算离子物质的量及其浓度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列溶液一定呈中性的是( )
| A、c(H+)=c(OH-)=10-6 mol?L-1溶液 |
| B、pH=7的溶液 |
| C、使石蕊试液呈红色的溶液 |
| D、由强酸与强碱等物质的量反应得到的溶液 |
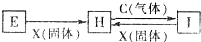 有关物质的转化关系如图所示(部分物质和条件已省去),C、X均是单质,H溶液呈浅绿色,I溶液呈棕黄色.下列有关判断正确的是( )
有关物质的转化关系如图所示(部分物质和条件已省去),C、X均是单质,H溶液呈浅绿色,I溶液呈棕黄色.下列有关判断正确的是( )| A、X固体可能是碘单质 |
| B、图中所示反应均为氧化还原反应 |
| C、1mol C与E溶液完全反应转移电子数为NA(NA为阿伏加德罗常数) |
| D、E、H、I溶液配制时,均需加酸防止其水解 |
下列方法不能用于进行金属防腐处理的是( )
| A、油漆 | B、铝热反应 |
| C、电镀 | D、改变金属内部结构 |
由14CO和12CO组成的混合气体与同温同压下空气的密度相等(空气的平均相对分子质量为29,)则下列关系正确的是( )
| A、混合气体中,12CO占有的体积大于14CO占有的体积 |
| B、混合气体中,12CO与14CO分子个数比为1:2 |
| C、混合气体中,12CO与14CO质量比为15:14 |
| D、混合气体中,12CO与14CO密度比为14:15 |