题目内容
在一个固定容积为500mL的密闭容器中,充入5mol H2和2mol CO.在一定温度下,发生如下反应在:2H2(g)+CO(g)?CH3OH(g),经过5min后达到平衡状态.若此时测得CH3OH蒸气的浓度为2mol/L.则:
(1)以H2的浓度变化表示的该反应的速率为多少?
(2)达平衡时CO的转化率?
(3)求该反应的平衡常数.
(1)以H2的浓度变化表示的该反应的速率为多少?
(2)达平衡时CO的转化率?
(3)求该反应的平衡常数.
考点:化学平衡的计算
专题:化学平衡专题
分析:依据化学平衡三段式列式计算,经过5min后达到平衡状态.若此时测得CH3OH蒸气的浓度为2mol/L.物质的量为0.5L×2mol/L=1mol;
2H2(g)+CO(g)?CH3OH(g)
起始量(mol) 5 2 0
变化量(mol) 2 1 1
平衡量(mol) 3 1 1
据此计算反应速率V=
,转化率=
×100%,平衡常数概念是生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积.
2H2(g)+CO(g)?CH3OH(g)
起始量(mol) 5 2 0
变化量(mol) 2 1 1
平衡量(mol) 3 1 1
据此计算反应速率V=
| △c |
| △t |
| 消耗量 |
| 起始量 |
解答:
解:经过5min后达到平衡状态.若此时测得CH3OH蒸气的浓度为2mol/L.物质的量为0.5L×2mol/L=1mol;
2H2(g)+CO(g)?CH3OH(g)
起始量(mol) 5 2 0
变化量(mol) 2 1 1
平衡量(mol) 3 1 1
(1)H2的浓度变化表示的该反应的速率=
=0.8mol/(L?min),答:以H2的浓度变化表示的该反应的速率为0.8mol/(L?min);
(2)一氧化碳转化率=
×100%=50%,答:达平衡时CO的转化率50%;
(3)反应的平衡常数K=
=0.028(L/mol)2,该反应的平衡常数为0.028(L/mol)2.
2H2(g)+CO(g)?CH3OH(g)
起始量(mol) 5 2 0
变化量(mol) 2 1 1
平衡量(mol) 3 1 1
(1)H2的浓度变化表示的该反应的速率=
| ||
| 5min |
(2)一氧化碳转化率=
| 1mol |
| 2mol |
(3)反应的平衡常数K=
| ||||
|
点评:本题考查了化学平衡的三段式计算应用,转化率、反应速率、平衡常数概念的计算分析是解题关键,题目难度中等.

练习册系列答案
相关题目
同分异构体现象在有机化学中是非常普遍的,下列有机物互为同分异构体的是① ②
② ③
③ ④HC≡CCH3 ⑤CH3CH2CH3 ⑥CH3CH=CHCH3( )
④HC≡CCH3 ⑤CH3CH2CH3 ⑥CH3CH=CHCH3( )
 ②
② ③
③ ④HC≡CCH3 ⑤CH3CH2CH3 ⑥CH3CH=CHCH3( )
④HC≡CCH3 ⑤CH3CH2CH3 ⑥CH3CH=CHCH3( )| A、①和② | B、①和③ |
| C、①和④ | D、③和⑥ |
下列反应的离子方程式正确的是( )
| A、向20mL0.5mol/LFeBr2(aq)中通入224mLCl2(标准状况):2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| B、在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入1~2滴盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O |
| C、酸性条件下,用FeCl3溶液吸收水煤气中的H2S,以回收硫元素、降低污染:2Fe3++H2S=2Fe2++S↓+2H+ |
| D、Ca(ClO)2浓溶液中通入足量的SO2:ClO-+SO2+H2O=2H++Cl-+SO42- |

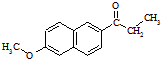 )外,最可能生成的副产物(与G互为同分异构体)的结构简式为
)外,最可能生成的副产物(与G互为同分异构体)的结构简式为 )的衍生物X是C的同分异构体,分子中含有2个取代基,且取代基在同一个苯环上;X在NaOH溶液中完全水解后,含萘环的水解产物的核磁共振氢谱有5个峰.写出X可能的结构简式:
)的衍生物X是C的同分异构体,分子中含有2个取代基,且取代基在同一个苯环上;X在NaOH溶液中完全水解后,含萘环的水解产物的核磁共振氢谱有5个峰.写出X可能的结构简式: 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).



