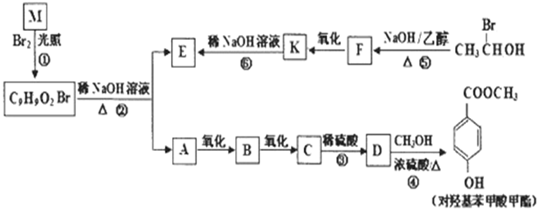
题目内容
通常状况下,CO是一种无色、无味、有毒的气体,难溶于水,与酸、碱、盐溶液均不反应.已知乙二酸晶体加热分解的方程式为:H2C2O4?2H2O
3H2O+CO2↑+CO↑,不考虑其他因素干扰,如何利用如图所示装置验证反应产物中含有CO2和CO(装置不能重复使用).酒精喷灯可作高温热源.请回答下列问题:
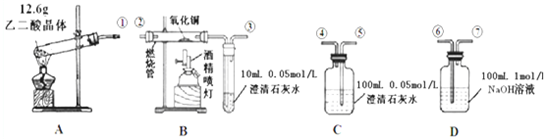
(1)检验装置A气密性的方法是 .
(2)按气流方向连接各仪器,用数字表示接口的连接顺序:①→ ;
(3)证明CO存在的实验现象是 ;
(4)本实验尾气处理的方法是 ;
(5)根据题给的数据,假设反应产生的气体全部排出,并与吸收液充分反应(提示:B、C中澄清石灰水均先变浑浊,后又变澄清),D中溶质及对应的物质的量是 .
| 175℃ |
| △ |

(1)检验装置A气密性的方法是
(2)按气流方向连接各仪器,用数字表示接口的连接顺序:①→
(3)证明CO存在的实验现象是
(4)本实验尾气处理的方法是
(5)根据题给的数据,假设反应产生的气体全部排出,并与吸收液充分反应(提示:B、C中澄清石灰水均先变浑浊,后又变澄清),D中溶质及对应的物质的量是
考点:探究物质的组成或测量物质的含量,常见气体的检验
专题:实验探究和数据处理题
分析:(1)根据检查装置气密性的方法及注意事项分析即可,装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;
(2)乙二酸晶体加热分解生成CO2和CO,此实验验证是反应产物中含有CO2和CO(装置不能重复使用),要验证二氧化碳与一氧化碳的存在,首先利用澄清石灰水用来验证二氧化碳的存在,然后除去二氧化碳再验证一氧化碳的存在,结合装置和试剂作用分析回答;
(3)一氧化碳与氧化铜反应生成二氧化碳,二氧化碳可使澄清石灰水变浑浊,据此分析解答;
(4)一氧化碳有毒,一氧化碳具有可燃性,燃烧生成无毒的二氧化碳,据此分析解答;
(5)B、C中澄清石灰水均先变浑浊,后又变澄清,说明二氧化碳与氢氧化钙发生:CO2+Ca(OH)2=CaCO3↓+H2O、CO2+H2O+CaCO3=Ca(HCO3)2,则D装置发生:CO2+2NaOH=Na2CO3+H2O、CO2+H2O+Na2CO3=2NaHCO3,结合相关数据即可解答.
(2)乙二酸晶体加热分解生成CO2和CO,此实验验证是反应产物中含有CO2和CO(装置不能重复使用),要验证二氧化碳与一氧化碳的存在,首先利用澄清石灰水用来验证二氧化碳的存在,然后除去二氧化碳再验证一氧化碳的存在,结合装置和试剂作用分析回答;
(3)一氧化碳与氧化铜反应生成二氧化碳,二氧化碳可使澄清石灰水变浑浊,据此分析解答;
(4)一氧化碳有毒,一氧化碳具有可燃性,燃烧生成无毒的二氧化碳,据此分析解答;
(5)B、C中澄清石灰水均先变浑浊,后又变澄清,说明二氧化碳与氢氧化钙发生:CO2+Ca(OH)2=CaCO3↓+H2O、CO2+H2O+CaCO3=Ca(HCO3)2,则D装置发生:CO2+2NaOH=Na2CO3+H2O、CO2+H2O+Na2CO3=2NaHCO3,结合相关数据即可解答.
解答:
解:(1)检查装置的气密性原理是根据装置内外的压强差形成水柱或气泡,所以检验装置气密性的方法是:连好装置,①处接长导管,将导管伸入盛有水的烧杯中,用手握住试管观察,若导管口产生连续气泡,松开手有小段水柱回流,则装置A气密性良好,
故答案为:连好装置,①处接长导管,将导管伸入盛有水的烧杯中,用手握住试管观察,若导管口产生连续气泡,松开手有小段水柱回流,则装置A气密性良好;
(2)乙二酸晶体加热分解生成CO2和CO装置A中的①导出气体,此实验验证是反应产物中含有CO2和CO(装置不能重复使用),应首先验证二氧化碳①→⑤→④,然后除去二氧化碳④→⑥→⑦,验证二氧化碳的方法是:把气体通入澄清的石灰水,澄清石灰水变浑浊,则含有二氧化碳;然后除去二氧化碳,二氧化碳与氢氧化钠反应除去,剩余为一氧化碳,验证一氧化碳存在⑦→②→③,一氧化碳与氧化铜反应生成二氧化碳,然后通入澄清石灰水,澄清石灰水变浑浊,则含有一氧化碳,
故答案为:⑤④⑥⑦②③;
(3)一氧化碳与氧化铜反应CuO+CO
Cu+CO2生成二氧化碳,B装置中黑色氧化铜变红,B中澄清石灰水变浑浊,则含CO,
故答案为:B装置中黑色氧化铜变红,澄清石灰水变浑浊,则含CO;
(4)一氧化碳有毒,一氧化碳具有可燃性,尾气处理的方法是点燃,2CO+O2
2CO2,一氧化碳燃烧生成二氧化碳,所以在导管③后放置一个燃着的酒精灯(或用气囊收集),
故答案为:在导管③后放置一个燃着的酒精灯(或用气囊收集);
(5)12.6克H2C2O4?2H2O的物质的量为n=
=
=0.1mol,乙二酸晶体加热分解H2C2O4?2H2O
3H2O+CO2↑+CO↑,则生成的一氧化碳、二氧化碳的物质的量分别为:0.1mol、0.1mol,反应产生的气体全部排出,并与吸收液充分反应,C装置中n(Ca(OH)2)=cv=0.05mol/L×0.1L=0.005mol,
CO2+Ca(OH)2=CaCO3↓+H2O、CO2+H2O+CaCO3=Ca(HCO3)2,即2CO2+Ca(OH)2=Ca(HCO3)2,则吸收的二氧化碳为0.01mol,剩余二氧化碳的物质的量为:0.1mol-0.01mol=0.09mol,0.09mol二氧化碳全部进入D装置且被吸收,D中n(NaOH)=cv=1mol/L×0.1L=0.1mol,
CO2 +2NaOH=Na2CO3+H2O CO2 +H2O+Na2CO3 =2NaHCO3
0.05mol 0.1mol 0.05mol 0.09mol-0.05mol 0.04mol 0.08mol
所以D中溶质及对应的物质的量是0.01mol Na2CO3和0.08mol NaHCO3,
故答案为:0.01mol Na2CO3和0.08mol NaHCO3.
故答案为:连好装置,①处接长导管,将导管伸入盛有水的烧杯中,用手握住试管观察,若导管口产生连续气泡,松开手有小段水柱回流,则装置A气密性良好;
(2)乙二酸晶体加热分解生成CO2和CO装置A中的①导出气体,此实验验证是反应产物中含有CO2和CO(装置不能重复使用),应首先验证二氧化碳①→⑤→④,然后除去二氧化碳④→⑥→⑦,验证二氧化碳的方法是:把气体通入澄清的石灰水,澄清石灰水变浑浊,则含有二氧化碳;然后除去二氧化碳,二氧化碳与氢氧化钠反应除去,剩余为一氧化碳,验证一氧化碳存在⑦→②→③,一氧化碳与氧化铜反应生成二氧化碳,然后通入澄清石灰水,澄清石灰水变浑浊,则含有一氧化碳,
故答案为:⑤④⑥⑦②③;
(3)一氧化碳与氧化铜反应CuO+CO
| ||
故答案为:B装置中黑色氧化铜变红,澄清石灰水变浑浊,则含CO;
(4)一氧化碳有毒,一氧化碳具有可燃性,尾气处理的方法是点燃,2CO+O2
| ||
故答案为:在导管③后放置一个燃着的酒精灯(或用气囊收集);
(5)12.6克H2C2O4?2H2O的物质的量为n=
| m |
| M |
| 12.6g |
| 126g/mol |
| 175℃ |
| △ |
CO2+Ca(OH)2=CaCO3↓+H2O、CO2+H2O+CaCO3=Ca(HCO3)2,即2CO2+Ca(OH)2=Ca(HCO3)2,则吸收的二氧化碳为0.01mol,剩余二氧化碳的物质的量为:0.1mol-0.01mol=0.09mol,0.09mol二氧化碳全部进入D装置且被吸收,D中n(NaOH)=cv=1mol/L×0.1L=0.1mol,
CO2 +2NaOH=Na2CO3+H2O CO2 +H2O+Na2CO3 =2NaHCO3
0.05mol 0.1mol 0.05mol 0.09mol-0.05mol 0.04mol 0.08mol
所以D中溶质及对应的物质的量是0.01mol Na2CO3和0.08mol NaHCO3,
故答案为:0.01mol Na2CO3和0.08mol NaHCO3.
点评:本题主要考查的乙二酸晶体加热分解产物的检验及相关计算,侧重于学生的分析能力、实验能力和计算能力的考查,注意掌握二氧化碳与一氧化碳的性质,以及结合反应CO2+Ca(OH)2=CaCO3↓+H2O、CO2+H2O+CaCO3=Ca(HCO3)2,CO2+2NaOH=Na2CO3+H2O、CO2+H2O+Na2CO3=2NaHCO3的方程式计算,该题注重实验的严谨及学生思维的严密性考查,注意把握物质的性质及差异,尤其是(5)0.1mol二氧化碳在C装置中吸收的二氧化碳为0.01mol,0.09mol二氧化碳全部进入D装置且被吸收,为易错点,题目难度中等.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
银锌碱性蓄电池是一种可以反复充电、放电的装置.电池放电时的反应原理是:Zn+Ag2O+H2O=2Ag+Zn(OH)2
现用该蓄电池电解含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,工作一段时间后测得蓄电池消耗了0.72gH2O(电解池的电极均为惰性电极).下列叙述正确的是( )
现用该蓄电池电解含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,工作一段时间后测得蓄电池消耗了0.72gH2O(电解池的电极均为惰性电极).下列叙述正确的是( )
| A、该电池负极反应为Ag2O+H2O+2e-═2Ag+2OH- |
| B、阳极产生的气体在标准状况下为0.448 L |
| C、阴极析出铜为2.56g |
| D、电解后溶液的pH=2(溶液的体积变化忽略不计) |
对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是( )
| A、温度下降10℃,两倍溶液的pH均不变 |
| B、分别加水稀释10倍,两溶液的pH仍相等 |
| C、用同溶液的盐酸中和,消耗的盐酸体积相同 |
| D、加入适量的氯化铵晶体,两溶液的pH均减小 |

 有图中所示转化关系(无机产物略):
有图中所示转化关系(无机产物略):