题目内容
利用如图装置探究氯气和氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为较纯净干燥的氯气与氨气反应的装置.

请回答下列问题:
(1)装置F中发生反应的离子方程式为 .
(2)装置A中的烧瓶内固体宜选用 (选填以下选项的代号).
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)按A接B接C;F接E接D接C,请在各虚线框内画上合适的装置图并注明所装试剂名称:
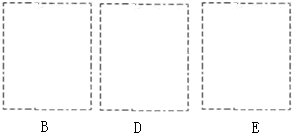
(4)在C中观察到大量白烟,同时产生一种气体单质,该反应的化学方程式为 ,反应中氧化剂与还原剂的物质的量比为 .设计一个实验方案鉴定该固体是氯化铵(要求写出操作、现象及结论): .
(5)从装置C的G处逸出的尾气可能含有污染环境的气体,如何处理: .

请回答下列问题:
(1)装置F中发生反应的离子方程式为
(2)装置A中的烧瓶内固体宜选用
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)按A接B接C;F接E接D接C,请在各虚线框内画上合适的装置图并注明所装试剂名称:

(4)在C中观察到大量白烟,同时产生一种气体单质,该反应的化学方程式为
(5)从装置C的G处逸出的尾气可能含有污染环境的气体,如何处理:
考点:氯、溴、碘的性质实验,氨的制取和性质
专题:实验题
分析:(1)二氧化锰和浓盐酸反应生成氯化锰、氯气和水,据离子方程式的书写方法来回答;
(2)浓氨水与生石灰或固体氢氧化钠或是生石灰混合得到氨气;
(3)A中浓氨水与生石灰或固体氢氧化钠或是生石灰混合得到氨气,经过B中干燥进入C中;F中二氧化锰与浓盐酸反应生成氯气,经过B除去HCl,经D干燥后进入C中,最后在C中氨气与氯气反应生成氯化铵固体和氮气,以此来解答;
(4)氯气和氨气之间反应的到氯化铵和氮气,根据化合价的变化来确定氧化剂与还原剂以及量的比值,根据根据铵根离子和氯离子的检验方法来回答;
(5)氯气的尾气处理用氢氧化钠,氨气的吸收可以用水溶液.
(2)浓氨水与生石灰或固体氢氧化钠或是生石灰混合得到氨气;
(3)A中浓氨水与生石灰或固体氢氧化钠或是生石灰混合得到氨气,经过B中干燥进入C中;F中二氧化锰与浓盐酸反应生成氯气,经过B除去HCl,经D干燥后进入C中,最后在C中氨气与氯气反应生成氯化铵固体和氮气,以此来解答;
(4)氯气和氨气之间反应的到氯化铵和氮气,根据化合价的变化来确定氧化剂与还原剂以及量的比值,根据根据铵根离子和氯离子的检验方法来回答;
(5)氯气的尾气处理用氢氧化钠,氨气的吸收可以用水溶液.
解答:
解:(1)二氧化锰和浓盐酸反应生成氯化锰、氯气和水,反应的离子方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
(2)浓氨水与生石灰或固体氢氧化钠或是生石灰混合得到氨气,故答案为:ABE;
(3)氨气,经过B中干燥进入C中;F中二氧化锰与浓盐酸反应生成氯气,经过B除去HCl,经D干燥后进入C中,最后在C中氨气与氯气反应生成氯化铵固体和氮气,其装置分别是: ,故答案为:
,故答案为: ;
;
(4)氯气和氨气之间反应的到氯化铵和氮气:3Cl2+8NH3=6NH4Cl+N2,N元素的化合价升高,Cl元素的化合价降低,所以氨气是还原剂,氯气是氧化剂,其物质的量之比是3:2,生成的产物是氯化铵,铵根离子与浓氢氧化钠溶液共热,产生氨气,氯离子遇到硝酸银溶液,产生不溶于硝酸的白色沉淀氯化银,据此检验离子的存在,
故答案为:3Cl2+8NH3=6NH4Cl+N2;3:2;取适量该白色固体与浓氢氧化钠溶液共热,产生能使湿润的红色石蕊试纸变蓝的无色气体;另取适量该白色固体,溶于水后加入硝酸银溶液,产生不溶于硝酸的白色沉淀;
(5)氯气的尾气处理用氢氧化钠,氨气的吸收可以用水溶液,所以最后将尾气通过一倒置的漏斗通入盛有NaOH溶液的烧杯中即可,
故答案为:将尾气通过一倒置的漏斗通入盛有NaOH溶液的烧杯.
| ||
| ||
(2)浓氨水与生石灰或固体氢氧化钠或是生石灰混合得到氨气,故答案为:ABE;
(3)氨气,经过B中干燥进入C中;F中二氧化锰与浓盐酸反应生成氯气,经过B除去HCl,经D干燥后进入C中,最后在C中氨气与氯气反应生成氯化铵固体和氮气,其装置分别是:
 ,故答案为:
,故答案为: ;
;(4)氯气和氨气之间反应的到氯化铵和氮气:3Cl2+8NH3=6NH4Cl+N2,N元素的化合价升高,Cl元素的化合价降低,所以氨气是还原剂,氯气是氧化剂,其物质的量之比是3:2,生成的产物是氯化铵,铵根离子与浓氢氧化钠溶液共热,产生氨气,氯离子遇到硝酸银溶液,产生不溶于硝酸的白色沉淀氯化银,据此检验离子的存在,
故答案为:3Cl2+8NH3=6NH4Cl+N2;3:2;取适量该白色固体与浓氢氧化钠溶液共热,产生能使湿润的红色石蕊试纸变蓝的无色气体;另取适量该白色固体,溶于水后加入硝酸银溶液,产生不溶于硝酸的白色沉淀;
(5)氯气的尾气处理用氢氧化钠,氨气的吸收可以用水溶液,所以最后将尾气通过一倒置的漏斗通入盛有NaOH溶液的烧杯中即可,
故答案为:将尾气通过一倒置的漏斗通入盛有NaOH溶液的烧杯.
点评:本题考查性质实验方案的设计,为高频考点,把握实验装置的作用、物质的性质为解答的关键,侧重分析与实验能力的综合考查,题目难度不大.

练习册系列答案
相关题目
常温下,由水电离出的c(OH-)=1×10-13mol/L的溶液中,可能大量共存的离子组是( )
| A、Cl-、NH4+、Na+、K+ |
| B、Fe3+、CH3COO-、K+、Ba2+ |
| C、CO32-、SO42-、Cl-、Na+ |
| D、NH4+、Mg2+、CO32-、Cl- |
下列元素的原子半径最大的是( )
| A、氮 | B、钠 | C、氧 | D、硫 |
下列反应的离子方程式正确的是( )
A、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
| ||||
| B、用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | ||||
C、实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-
| ||||
| D、用FeCl3溶液腐蚀印刷铜电路板:Fe3++Cu═Fe2++Cu2+ |
在一定温度下,向饱和氢氧化钠溶液中加入一定量的过氧化钠固体,充分反应后恢复到原来温度下,下列说法正确的是( )
| A、溶液的pH不变,有氢气放出 |
| B、溶液的pH增大,有氧气放出 |
| C、溶液中Na+数目减小,有氧气放出 |
| D、溶液中c(Na+)增大,有氧气放出 |