题目内容
对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是( )
| A、温度下降10℃,两倍溶液的pH均不变 |
| B、分别加水稀释10倍,两溶液的pH仍相等 |
| C、用同溶液的盐酸中和,消耗的盐酸体积相同 |
| D、加入适量的氯化铵晶体,两溶液的pH均减小 |
考点:弱电解质在水溶液中的电离平衡,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:室温下,pH相等氨水和NaOH溶液中,氨水浓度大于NaOH,
A、降低温度,一水合氨电离程度减小;
B、加水稀释促进一水合氨电离;
C、用HCl中和,消耗盐酸的体积与碱的物质的量成正比;
D、加入适量的氯化铵晶体,抑制一水合氨电离,NaOH和氯化铵反应生成氯化钠和一水合氨.
A、降低温度,一水合氨电离程度减小;
B、加水稀释促进一水合氨电离;
C、用HCl中和,消耗盐酸的体积与碱的物质的量成正比;
D、加入适量的氯化铵晶体,抑制一水合氨电离,NaOH和氯化铵反应生成氯化钠和一水合氨.
解答:
解:室温下,pH相等氨水和NaOH溶液中,氨水浓度大于NaOH,
A、降低温度,一水合氨电离程度减小,所以氨水的pH减小,故A错误;
B、加水稀释促进一水合氨电离,则稀释后氨水的pH大于氢氧化钠,故B错误;
C、用HCl中和,消耗盐酸的体积与碱的物质的量成正比,pH相等、体积相等的氨水和氢氧化钠溶液,一水合氨的物质的量大于氢氧化钠,所以氢氧化钠消耗的盐酸少,故C错误;
D、加入适量的氯化铵晶体,抑制一水合氨电离,NaOH和氯化铵反应生成氯化钠和一水合氨,所以加入适量的氯化铵晶体后,两溶液的pH均碱小,故D正确;
故选D.
A、降低温度,一水合氨电离程度减小,所以氨水的pH减小,故A错误;
B、加水稀释促进一水合氨电离,则稀释后氨水的pH大于氢氧化钠,故B错误;
C、用HCl中和,消耗盐酸的体积与碱的物质的量成正比,pH相等、体积相等的氨水和氢氧化钠溶液,一水合氨的物质的量大于氢氧化钠,所以氢氧化钠消耗的盐酸少,故C错误;
D、加入适量的氯化铵晶体,抑制一水合氨电离,NaOH和氯化铵反应生成氯化钠和一水合氨,所以加入适量的氯化铵晶体后,两溶液的pH均碱小,故D正确;
故选D.
点评:本题考查了弱电解质的电离,明确弱电解质的电离特点是解本题关键,易错选项是D,注意消耗酸的物质的量与碱的物质的量成正比,与电解质强弱无关,为易错点.

练习册系列答案
相关题目
水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O下列说法正确的是( )
| A、该反应中铁元素被氧化,硫元素被还原 |
| B、该反应中每消耗3molFe2+,3molFe2+失去3mol电子 |
| C、该反应中转移电子总数为4e- |
| D、Fe2+、S2O32-在碱性条件下能大量共存 |
下列材料属于硅酸盐材料的是( )
| A、不锈钢 | B、光纤 | C、水泥 | D、塑料 |
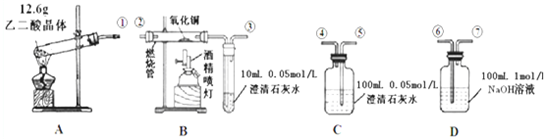

 Fenton法常用于处理含难降解有机物的工业废水,通常先调节好Fe2+等离子的浓度,再向废水中加入H2O2,所产生的羟基自由基(Fe2++H2O2→Fe3++OH-+HO?)能氧化降解污染物.如:降解废水中丙二醇(分子式C3H8O2)的反应为:C3H8O2+8H2O2
Fenton法常用于处理含难降解有机物的工业废水,通常先调节好Fe2+等离子的浓度,再向废水中加入H2O2,所产生的羟基自由基(Fe2++H2O2→Fe3++OH-+HO?)能氧化降解污染物.如:降解废水中丙二醇(分子式C3H8O2)的反应为:C3H8O2+8H2O2