题目内容
已知:食盐晶体与浓硫酸能发生如下反应:NaCl+H2SO4(浓)═NaHSO4+HCl↑、2NaCl+H2SO4(浓)
Na2SO4+2HCl↑、Na2SO4(s)+H2SO4(浓)
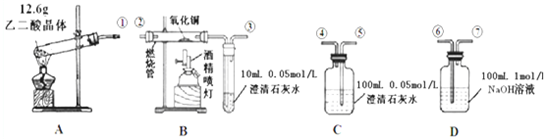
2NaHSO4.现将5.85g食盐晶体与20mL18.4mol?L-1的浓硫酸混合强热制取HCl气体后,现对反应混合物中可能含有的离子进行鉴定.除制取HCl气体外,其它实验可能用到的玻璃仪器及试剂、试纸不出下列范围:
玻璃仪器:试管、烧杯、滴管、玻璃棒、分液漏斗、酒精灯、蓝色钴玻璃、普通玻璃片;
试剂(纸):稀盐酸、NaOH溶液、Ba(OH)2溶液、Ba(NO3)2溶液、BaCl2溶液、酚酞、红色石蕊试纸、pH试纸、淀粉KI试纸、AgNO3溶液等.
回答下列问题:
(1)上述反应的总化学反应方程式为
A、NaCl+H2SO4(浓)
NaHSO4+HCl↑
B、2NaCl+H2SO4(浓)
Na2SO4+2HCl↑
C、NaCl+H2SO4(浓)
NaHSO4+HCl↑
D、2NaCl+H2SO4(浓)
Na2SO4+2HCl
(2)将制取气体后的反应混合液配成稀溶液的办法是
(3)为证明所得稀溶液中含Na+离子应做 实验,现象是 .
(4)要检验稀溶液中H+是否大量存在,应选用的仪器、试剂或试纸是
(5)设计一个简单实验,确认稀溶液中是否含有Cl-离子: .
| ||
| ||
玻璃仪器:试管、烧杯、滴管、玻璃棒、分液漏斗、酒精灯、蓝色钴玻璃、普通玻璃片;
试剂(纸):稀盐酸、NaOH溶液、Ba(OH)2溶液、Ba(NO3)2溶液、BaCl2溶液、酚酞、红色石蕊试纸、pH试纸、淀粉KI试纸、AgNO3溶液等.
回答下列问题:
(1)上述反应的总化学反应方程式为
A、NaCl+H2SO4(浓)
| ||
B、2NaCl+H2SO4(浓)
| ||
C、NaCl+H2SO4(浓)
| ||
D、2NaCl+H2SO4(浓)
| ||
(2)将制取气体后的反应混合液配成稀溶液的办法是
(3)为证明所得稀溶液中含Na+离子应做
(4)要检验稀溶液中H+是否大量存在,应选用的仪器、试剂或试纸是
(5)设计一个简单实验,确认稀溶液中是否含有Cl-离子:
考点:物质的检验和鉴别的实验方案设计
专题:实验设计题
分析:(1)现将5.85g食盐晶体与20mL18.4mol?L-1的浓硫酸混合强热制取HCl气体,n(NaCl)=0.1mol,n(H2SO4)=0.02L×18.4mol/L=0.368mol,浓硫酸过量;
(2)浓硫酸过量,可类似浓硫酸的稀释配成稀溶液;
(3)Na为活泼金属,检验其离子应选择焰色反应实验;
(4)检验稀溶液中H+,即说明具有强酸性,可利用pH进行定量实验分析;
(5)确认稀溶液中是否含有Cl-离子,先排除硫酸根离子的干扰,再利用硝酸银、硝酸来检验.
(2)浓硫酸过量,可类似浓硫酸的稀释配成稀溶液;
(3)Na为活泼金属,检验其离子应选择焰色反应实验;
(4)检验稀溶液中H+,即说明具有强酸性,可利用pH进行定量实验分析;
(5)确认稀溶液中是否含有Cl-离子,先排除硫酸根离子的干扰,再利用硝酸银、硝酸来检验.
解答:
解:(1)现将5.85g食盐晶体与20mL18.4mol?L-1的浓硫酸混合强热制取HCl气体,n(NaCl)=0.1mol,n(H2SO4)=0.02L×18.4mol/L=0.368mol,浓硫酸过量,则发生的反应为NaCl+H2SO4(浓)
NaHSO4+HCl↑,故答案为:C;
(2)因浓硫酸过量,则制取气体后的反应混合液配成稀溶液的办法是将反应后的混合液沿烧杯内壁缓缓倒入水中,并不断搅拌,
故答案为:将反应后的混合液沿烧杯内壁缓缓倒入水中,并不断搅拌;
(3)Na为活泼金属,检验其离子应选择焰色反应实验,观察到的现象为产生黄色火焰,
故答案为:焰色反应;产生黄色火焰;
(4)检验稀溶液中H+,即说明具有强酸性,应选用的仪器、试剂或试纸是普通玻璃片、玻璃棒、pH试纸,以此进行定量测定可检验,故答案为:普通玻璃片、玻璃棒、pH试纸;
(5)确认稀溶液中是否含有Cl-离子,先排除硫酸根离子的干扰,再利用硝酸银、硝酸来检验,则设计的实验为用一支试管取少量待测液,然后向其中加入足量的Ba(NO3)2溶液,静置分层后用胶头滴管取上层清液滴加AgNO3溶液,看是否有白色沉淀生成,故答案为:用一支试管取少量待测液,然后向其中加入足量的Ba(NO3)2溶液,静置分层后用胶头滴管取上层清液滴加AgNO3溶液,看是否有白色沉淀生成.
| ||
(2)因浓硫酸过量,则制取气体后的反应混合液配成稀溶液的办法是将反应后的混合液沿烧杯内壁缓缓倒入水中,并不断搅拌,
故答案为:将反应后的混合液沿烧杯内壁缓缓倒入水中,并不断搅拌;
(3)Na为活泼金属,检验其离子应选择焰色反应实验,观察到的现象为产生黄色火焰,
故答案为:焰色反应;产生黄色火焰;
(4)检验稀溶液中H+,即说明具有强酸性,应选用的仪器、试剂或试纸是普通玻璃片、玻璃棒、pH试纸,以此进行定量测定可检验,故答案为:普通玻璃片、玻璃棒、pH试纸;
(5)确认稀溶液中是否含有Cl-离子,先排除硫酸根离子的干扰,再利用硝酸银、硝酸来检验,则设计的实验为用一支试管取少量待测液,然后向其中加入足量的Ba(NO3)2溶液,静置分层后用胶头滴管取上层清液滴加AgNO3溶液,看是否有白色沉淀生成,故答案为:用一支试管取少量待测液,然后向其中加入足量的Ba(NO3)2溶液,静置分层后用胶头滴管取上层清液滴加AgNO3溶液,看是否有白色沉淀生成.
点评:本题考查物质鉴别和检验实验方案的设计,为高频考点,把握浓硫酸的量级稀释操作、离子检验等为解答的关键,注意(5)中因没有普通漏斗则不能采取过滤的方法,还应注意排除硫酸根离子的干扰,题目难度中等.

练习册系列答案
相关题目
在一定温度下,向饱和氢氧化钠溶液中加入一定量的过氧化钠固体,充分反应后恢复到原来温度下,下列说法正确的是( )
| A、溶液的pH不变,有氢气放出 |
| B、溶液的pH增大,有氧气放出 |
| C、溶液中Na+数目减小,有氧气放出 |
| D、溶液中c(Na+)增大,有氧气放出 |
下列材料属于硅酸盐材料的是( )
| A、不锈钢 | B、光纤 | C、水泥 | D、塑料 |
用铂电极电解下列溶液时,阴极和阳极的主要产物分别为H2和O2的是( )
| A、稀NaOH溶液 |
| B、HCl溶液 |
| C、CuCl2溶液 |
| D、酸性AgNO3溶液 |