题目内容
3.下列热化学方程式的书写及相关说法正确的是( )| A. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| B. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-101.5 kJ•mol-1,该方程式的△H可表示碳的燃烧热 | |
| C. | 已知:C(s)+O2(g)=CO2(g)△H1C(s)+$\frac{1}{2}$O2(g)=CO (g)△H2,则△H1<△H2 | |
| D. | Ba(OH)2(aq)+H2SO4(aq))=BaSO4(s)+2H2O(l)△H=-2a kJ•mol-1,则任何强酸和强碱发生中和反应生成1 mol H2O(l)的反应热均为-a kJ•mol-1 |
分析 A.物质具有能量越高,物质的稳定性越低;
B.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放的热量,二氧化碳比CO稳定;
C.C完全燃烧放出热量多,焓变为负值,放出热量越多,焓变越小;
D.氢氧化钡和硫酸反应生成硫酸钡和水,硫酸钡的生成过程是放热,中和热是稀的强酸强碱生成1mol水放出的热量分析.
解答 解:A.C(石墨,s)═C(金刚石,s)△H>0,该反应我吸热反应,则金刚石能量高,石墨比金刚石稳定,故A错误;
B.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放的热量,选项中生成的一氧化碳不是稳定氧化物,不符合燃烧热概念,故B错误;
C.已知:C(s)+O2(g)=CO2(g)△H1 C(s)+$\frac{1}{2}$O2(g)=CO (g)△H2,前者为完全燃烧,放出热量大于后者,焓变为负值,则△H1<△H2,故C正确;
D.氢氧化钡和硫酸反应生成硫酸钡和水,硫酸钡的生成过程是放热,中和热是强酸强碱生成1mol水放出的热量,强酸强碱中和热△H>-aKJ/mol,故D错误;
故选C.
点评 本题考查了热化学方程式书写方法和反应能量变化,掌握盖斯定律和燃烧热、中和热概念的实质是关键,题目难度中等.

练习册系列答案
 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
19.Mg-AgCl电池是一种以海水为电解质溶液的水激活电池.下列叙述错误的是( )
| A. | 负极反应式为Mg-2e-=Mg2+ | |
| B. | 负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑ | |
| C. | 正极反应式为Ag++e-=Ag | |
| D. | 电池放电时Cl-由正极向负极迁移 |
18.下列说法中正确的是( )
| A. | 含有少量碳酸氢钙和氯化钙的水是永久硬水 | |
| B. | 明矾有净水作用,所以用明矾处理硬水,可以使硬水软化 | |
| C. | 用离子交换剂处理硬水,可使硬水软化 | |
| D. | 只具有永久硬度的水经加热煮沸后,可变成软水 |
15.如表,已知短周期元素甲、乙、丙、丁、戊的原子序数依次增大,常温下其氢化物中甲、乙、丙、丁、戊的化合价如下,下列说法正确的是( )
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
| A. | 乙的常见氧化物有两种 | |
| B. | 气态氢化物稳定性:丙<丁 | |
| C. | 丙的氧化物能与戊的氢化物的水溶液反应 | |
| D. | 原子半径大小:甲>丙 |
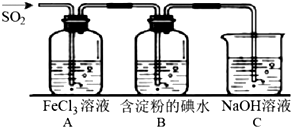
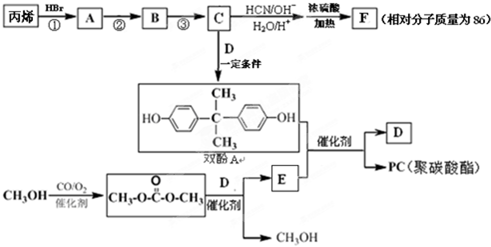
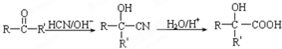
 (R、R′、R″代表羟基)
(R、R′、R″代表羟基) .
.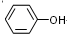 .
. .
.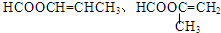 .
.