题目内容
19.Mg-AgCl电池是一种以海水为电解质溶液的水激活电池.下列叙述错误的是( )| A. | 负极反应式为Mg-2e-=Mg2+ | |
| B. | 负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑ | |
| C. | 正极反应式为Ag++e-=Ag | |
| D. | 电池放电时Cl-由正极向负极迁移 |
分析 Mg-AgCl电池中,活泼金属Mg是还原剂、AgCl是氧化剂,金属Mg作负极,正极反应为2AgCl+2e-═2Cl-+2Ag,负极反应式为Mg-2e-=Mg2+,据此分析.
解答 解:A.活泼金属镁作负极,失电子发生氧化反应,反应式为:Mg-2e-=Mg2+,故A正确;
B.镁是活泼金属与水反应,即Mg+2H2O=Mg(OH)2+H2↑,故B正确;
C.AgCl是难溶物,其电极反应式为:2AgCl+2e-═2Cl-+2Ag,故C错误;
D.原电池放电时,阴离子向负极移动,则Cl-在正极产生由正极向负极迁移,故D正确;
故选:C.
点评 本题考查原电池工作原理,注意常见物质的性质,如镁的还原性以及银离子的氧化性是解题的关键,题目难度中等.

练习册系列答案
相关题目
9.若阿伏加德罗常数的数值为NA,则下列说法中正确的是( )
| A. | 1 molFe与过量的氯气反应,转移电子的数目为2 NA | |
| B. | 2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA | |
| C. | 1.0L0.1 mol•L-1Na2S溶液中含有的S2-离子数小于0.1NA | |
| D. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
10.在由Na2S、Na2SO3、Na2SO4组成的固体混合物中,已知S的质量分数为32.0%,则氧的质量分数为( )
| A. | 32.0% | B. | 22.0% | C. | 45.0% | D. | 无法计算 |
14.同温同压下,同质量的CO2与N2O不具有相同的( )
| A. | 分子数 | B. | 原子数 | C. | 密度 | D. | 化学性质 |
4.设NA表示阿伏加德罗常数数值,下列叙述中正确的是( )
| A. | 1.8 g的NH4+离子中含有的电子数为0.1NA | |
| B. | 1mol Na2O2 固体中含离子总数为4NA | |
| C. | 标准状况下,2.24L CCl4所含的共价键数为O.4NA | |
| D. | 常温常压下,92g NO2和N2O4的混合气体含有的原子数为6NA |
8.下列离子在溶液中因发生氧化还原反应而不能大最共存的是( )
| A. | K+、Ba2+、OH-、SO42- | B. | Ag+、NO3-、Cl-、K+ | ||
| C. | H3O+、NO3-、Fe2+、Na+ | D. | Cu2+、NH4+、Br-、OH- |
3.下列热化学方程式的书写及相关说法正确的是( )
| A. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| B. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-101.5 kJ•mol-1,该方程式的△H可表示碳的燃烧热 | |
| C. | 已知:C(s)+O2(g)=CO2(g)△H1C(s)+$\frac{1}{2}$O2(g)=CO (g)△H2,则△H1<△H2 | |
| D. | Ba(OH)2(aq)+H2SO4(aq))=BaSO4(s)+2H2O(l)△H=-2a kJ•mol-1,则任何强酸和强碱发生中和反应生成1 mol H2O(l)的反应热均为-a kJ•mol-1 |
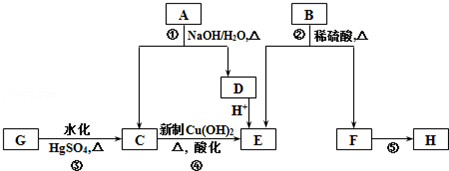
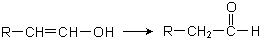
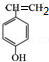
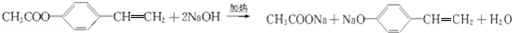 .
.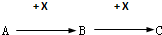
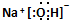 .
.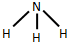 ,写出A生成B的反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
,写出A生成B的反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.