题目内容
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、32g甲醇中含有C-H键的数目为4NA |
| B、1L 0.1mol?L-1的氨水含有0.1NA个OH- |
| C、10L pH=1的硫酸溶液中含有的H+数为2NA |
| D、H2S和SO2气体混合生成0.3mol单质硫时,转移电子的数目为0.4NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、32g甲醇的物质的量为1mol,甲醇分子中含有3个碳氢键、1个碳氢键、1个氧氢键;
B、一水合氨为弱电解质,溶液中只能部分电离出氢氧根离子;
C、氢离子浓度为0.1mol/L,10L溶液中氢离子的物质的量为1mol.
D、根据反应方程式2H2S+SO2=3S+2H2O分析生成0.3mol单质硫转移的电子数.
B、一水合氨为弱电解质,溶液中只能部分电离出氢氧根离子;
C、氢离子浓度为0.1mol/L,10L溶液中氢离子的物质的量为1mol.
D、根据反应方程式2H2S+SO2=3S+2H2O分析生成0.3mol单质硫转移的电子数.
解答:
解:A、甲醇分子中含有3个碳氢键,32g甲醇的物质的量为1mol,含有3mol碳氢键,含有C-H键的数目为3NA,故A错误;
B、1L 0.1mol?L-1的氨水中含有溶质0.1mol,由于一水合氨为弱电解质,溶液中电离的氢氧根离子一定小于0.1mol,含有的氢氧根离子数目一定小于0.1NA,故B错误;
C、10L pH=1的硫酸溶液中氢离子浓度为0.1mol/L,10L溶液中氢离子的物质的量为1mol,含有的H+数为NA,故C错误;
D、反应2H2S+SO2=3S+2H2O中,生成0.3molS,消耗了0.1mol二氧化硫,转移了0.4mol电子,转移电子的数目为0.4NA,故D正确;
故选D.
B、1L 0.1mol?L-1的氨水中含有溶质0.1mol,由于一水合氨为弱电解质,溶液中电离的氢氧根离子一定小于0.1mol,含有的氢氧根离子数目一定小于0.1NA,故B错误;
C、10L pH=1的硫酸溶液中氢离子浓度为0.1mol/L,10L溶液中氢离子的物质的量为1mol,含有的H+数为NA,故C错误;
D、反应2H2S+SO2=3S+2H2O中,生成0.3molS,消耗了0.1mol二氧化硫,转移了0.4mol电子,转移电子的数目为0.4NA,故D正确;
故选D.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项C为易错点,注意认真分析题意.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、1mol/L的NaOH溶液中Na+的物质的量为1mol |
| B、28g乙烯所含共用电子对数目为4NA |
| C、常温常压下,32g O2与O3的混合气体中含有的原子总数为2NA |
| D、1mol苯中含有碳碳双键的数目为3NA |
解释下列事实的方程式正确的是( )
| A、用碳酸钠溶液处理水垢中的硫酸钙:Ca2++CO32-=CaCO3↓ | ||||
| B、SO2使紫色石蕊溶液变红色:SO2+H2O=2H++SO32- | ||||
| C、用石墨电极电解AlCl3溶液,阴极附近生成沉淀:2Al3++6H2O+6e-=2Al(OH)3↓+3H2↑ | ||||
D、工业上制取硅:SiO2+C
|
如图所示的装置能够组成原电池产生电流的是( )
A、 稀硫酸钠 |
B、 NaCl溶液 |
C、 |
D、 酒精 |
对水的电离平衡不产生影响的粒子是( )
| A、Al3+ |
| B、H+ |
| C、OH- |
| D、NO3- |
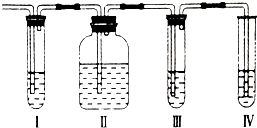 在实验室里制取的乙烯中常混有少量的二氧化硫,某化学兴趣小组设计了如图所示的实验装置以确认上述混合气体中是否含有SO2和C2H4.请回答下列问题:
在实验室里制取的乙烯中常混有少量的二氧化硫,某化学兴趣小组设计了如图所示的实验装置以确认上述混合气体中是否含有SO2和C2H4.请回答下列问题: (1)用FeCl3溶液腐蚀印刷电路铜板的化学方程式为:
(1)用FeCl3溶液腐蚀印刷电路铜板的化学方程式为: