题目内容
 (1)用FeCl3溶液腐蚀印刷电路铜板的化学方程式为:
(1)用FeCl3溶液腐蚀印刷电路铜板的化学方程式为:的原电池,请在图中完成标注
(2)实验证明,能设计成原电池的反应通常是放热反应,现有下列反应:
①C(s)+H2O(g)=CO(g)+H2(g)△H>0;
②2H2(g)+O2(g)=2H2O(1)△H<0;
③NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0.
上述反应可以设计成原电池的是
考点:设计原电池
专题:电化学专题
分析:(1)Fe3+有强氧化性,能把金属铜氧化成铜离子;根据电池反应式设计原电池,由发生反应的反应类型设计正负极,将发生氧化反应的金属单质设计成负极,比负极不活泼的金属或导电的非金属设计成正极,反应物中的电解质设计为电解质溶液;
(2)能设计成原电池的反应应是能自发进行的氧化还原反应.
(2)能设计成原电池的反应应是能自发进行的氧化还原反应.
解答:
解:(1)Fe3+有强氧化性,能把金属铜氧化成铜离子,自身被还原成 Fe2+,反应方程式为2FeCl3+Cu=2FeCl2+CuCl2,设计成原电池时,负极上发生氧化反应,正极上发生还原反应,该电池反应中三价铁离子得电子发生还原反应,所以正极上的电极反应式为Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+),铜失电子发生氧化反应,所以负极上的电极反应式为Cu=2Cu2++2e-(或Cu-2e-=Cu2+);
电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,所以该原电池图为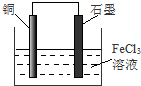 ,
,
故答案为:2FeCl3+Cu=2FeCl2+CuCl2; ;
;
(2)能设计成原电池的反应应是能自发进行的氧化还原反应,而①为吸热反应,③不是氧化还原反应,都不能设计成原电池,②为氧化还原反应,且放热,则可设计成原电池,氢气在负极被氧化生成水,电极方程式为H2-2e-+2OH-=2H2O或H2+2OH-=2H2O+2e-,
故答案为:②;H2-2e-+2OH-=2H2O或H2+2OH-=2H2O+2e-.
电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,所以该原电池图为
 ,
,故答案为:2FeCl3+Cu=2FeCl2+CuCl2;
 ;
;(2)能设计成原电池的反应应是能自发进行的氧化还原反应,而①为吸热反应,③不是氧化还原反应,都不能设计成原电池,②为氧化还原反应,且放热,则可设计成原电池,氢气在负极被氧化生成水,电极方程式为H2-2e-+2OH-=2H2O或H2+2OH-=2H2O+2e-,
故答案为:②;H2-2e-+2OH-=2H2O或H2+2OH-=2H2O+2e-.
点评:本题考查原电池的设计,侧重于学生的分析能力和电化学知识的综合考查,为高考常见题型和高频考点,难度不大,明确原电池的构成条件及反应必须是放热反应是解本题的关键.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、32g甲醇中含有C-H键的数目为4NA |
| B、1L 0.1mol?L-1的氨水含有0.1NA个OH- |
| C、10L pH=1的硫酸溶液中含有的H+数为2NA |
| D、H2S和SO2气体混合生成0.3mol单质硫时,转移电子的数目为0.4NA |
0.2mol锌和足量的稀盐酸反应,在标准状态下生成氢气的体积是( )
| A、4.48 L |
| B、2.24 L |
| C、1.12 L |
| D、0.2 L |
室温下,下列溶液等体积混合后的pH一定大于7的是( )
| A、0.1 mol?L--1的盐酸和0.1 mol?L-1的氢氧化钠溶液 |
| B、pH=4的盐酸和pH=10的氢氧化钡溶液 |
| C、pH=4的醋酸溶液和pH=10的氢氧化钠溶液 |
| D、pH=4的盐酸和pH=10的氨水 |
滴加新制氯水后,下列各组离子可能大量存在的是( )
| A、Fe3+、Cl-、NO3- |
| B、Na+、HCO3-、SO42- |
| C、Ag+、NH4+、NO3- |
| D、Na+、SO32-、SO42- |

 已知某待测液由Ag+、Fe2+、Al3+、K+、Ba2+、NH4+、NO3-、SO42-中的若干种离子组成,进行如下实验:
已知某待测液由Ag+、Fe2+、Al3+、K+、Ba2+、NH4+、NO3-、SO42-中的若干种离子组成,进行如下实验: