题目内容
2.为了探究过氧化钠的强氧化性,某研究性学习小组设计了如图所示的实验装置.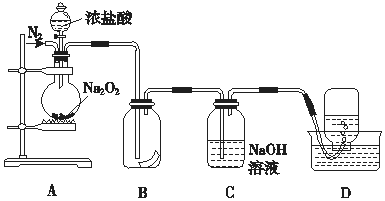
实验步骤及现象如下:
①检查装置气密性后,装入药品Na2O2并连接仪器.
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸
入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,剧烈反应,产生黄绿色气体.
③一段时间后,将导管末端伸入集气瓶中收集气体.装置D中收集到能使带火星的木条复燃的无色气体.
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色.
回答下列问题:
(1)装置B中湿润的红色纸条褪色,证明A中反应有Cl2(填化学式)生成.若将B中红纸条改为湿润的紫石蕊试纸,现象为先变红后变白
(2)实验前通N2的目的排尽装置内的氧气和CO2,装置C的作用是吸收HCl和过量的Cl2,防止污染空气,使D中能收集到较为纯净的氧气
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得.乙同学认为此结论不正确,其不赞成的理由可能为:①Na2O2被还原时氧元素的化合价应该降低,不可能得到O2; ②O2有可能是Na2O2与盐酸中的H2O反应所得.
分析 A装置:浓盐酸和过氧化钠反应,B装置:探究A中反应有氯气生成,C装置:除去氧气中的氯气,D装置:用排水法收集氧气.
(1)氯气和水反应生成HClO;酸能使湿润的紫石蕊试纸变红,次氯酸具有漂白性;
(2)装置内有氧气和CO2,为避免干扰后续实验,需排尽,Cl2有毒不能直接排空,如果O2中混有Cl2,会导致收集的O2不纯净;
(3)如果Na2O2被还原,则O元素应该得电子化合价降低;Na2O2还能和水反应生成氧气.
解答 解:(1)湿润的红色石蕊试纸褪色,说明有HClO生成,氯气和水反应生成HClO,所以说明装置A中有Cl2生成;若B中改放湿润的紫石蕊试纸,氯气和水反应生成HClO,酸能使湿润的紫石蕊试纸变红,次氯酸具有漂白性能使红色变白,所以将B中红纸条改为湿润的紫石蕊试纸,现象为先变红后变白,
故答案为:Cl2;先变红后变白;
(2)后续实验需检验是否有氧气生成,而装置中残留氧气,空气中的二氧化碳也能与过氧化钠反应,所以需除去,所以实验前通N2的目的排尽装置内的氧气和CO2,Cl2有毒不能直接排空,如果O2中混有Cl2,会导致收集的O2不纯净,且盐酸具有挥发性,导致生成的气体中含有HCl,氯气、HCl都能和NaOH反应而除去,则NaOH的作用是吸收HCl和过量的Cl2,防止污染空气,使D中能收集到较为纯净的氧气,
故答案为:吸收HCl和过量的Cl2,防止污染空气,使D中能收集到较为纯净的氧气;
(3)①如果Na2O2被还原,则O元素应该得电子化合价降低,不能是化合价升高,
Na2O2被还原时氧元素的化合价应该降低,不可能得到O2
②水和过氧化钠反应也生成氧气,O2有可能是Na2O2与盐酸中的H2O反应生成的;
故答案为:Na2O2被还原时氧元素的化合价应该降低,不可能得到O2.
点评 本题考查过氧化钠性质实验探究,侧重考查分析问题能力,物质的性质是实验设计的依据,需熟练掌握元素化合物知识,性质、制备实验方案设计是高考高频点,题目难度中等.

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案| A. | 足量硫酸铝与纯碱反应:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ | |
| B. | 硫酸铜与烧碱反应:CuSO4+2OH-═Cu(OH)2↓+SO42- | |
| C. | 苯酚与碳酸钠反应:2C6H5OH+CO32-═2C6H5O-+CO2↑+H2O | |
| D. | 碳酸钡与硫酸反应:Ba2++SO42-═BaSO4↓ |
| A. | 还原产物为CH3COOH | |
| B. | 氧化剂与还原剂的物质的量之比为2:3 | |
| C. | Cr2O72-和Cr3+分别属于反应物和生成物 | |
| D. | 若把该反应设计从成原电池,则负极反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+ |
| A. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 | |
| B. | 石油裂解、煤的气化、葡萄糖制取酒精等过程中都包含化学变化 | |
| C. | 低碳经济就是以低能耗、低污染、低排放为基础的经济发展模式 | |
| D. | 食用植物油、麦芽糖和石油气都是纯净物 |
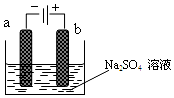 如图为电解稀Na2SO4水溶液的装置,通电后,石墨两极附近分别滴加几滴酚酞溶液,下列有关说法不正确的是( )
如图为电解稀Na2SO4水溶液的装置,通电后,石墨两极附近分别滴加几滴酚酞溶液,下列有关说法不正确的是( )| A. | a电极附近呈红色,b电极附近无明显变化 | |
| B. | 逸出气体的体积,a电极的大于b电极的 | |
| C. | Na2SO4水溶液浓度逐渐增大 | |
| D. | 当电路中通过0.04mol e-时,a电极逸出气体的体积为448mL |
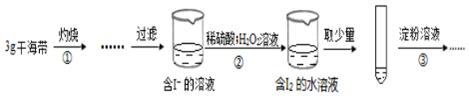
下列说法不正确的是( )
| A. | 步骤①需要将干海带放入坩埚中灼烧 | |
| B. | 步骤②反应的离子方程式为:2I-+2H++H2O2=I2+2H2O | |
| C. | 步骤③操作后,观察到试管中溶液变为蓝色,可以说明海带中含有碘元素 | |
| D. | 若步骤②仅滴加稀硫酸后放置一会儿,步骤③操作后,试管中溶液颜色无明显变化 |
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | CH3OH的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | |||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该反应的正反应吸热 | |
| B. | 达到平衡时,容器II中c(CH3OH)小于容器I中c(CH3OH)的两倍 | |
| C. | 达到平衡时,容器II中c(H2)大于容器III中c(H2)的两倍 | |
| D. | 达到平衡时,容器III中的正反应速率比容器I中的大 |
| A. | 淀粉与纤维素互为同分异构体 | |
| B. | 正丁烷的二氯代物有6种 | |
| C. | 糖类、油脂、蛋白质均为高分子化合物 | |
| D. | 乙烯使酸性高锰酸钾溶液褪色与乙烯使酸性重铬酸钾变色原理不同 |



